合金热力学(卷名:矿冶)
thermodynamics of alloys
应用热力学和统计物理研究合金的相图、相变及有关性能等问题的学科。合金热力学又叫固体热力学或材料热力学,即将研究的对象推广到固体或材料。合金热力学又叫冶金热力学,则将它推广到广泛的冶金现象。合金热力学又叫合金能量学,强调它用能量的观点,处理有关合金的问题。
合金热力学的理论基础 经典热力学 经典热力学是现象理论。它所依据的是从无数经验归纳出的三个定律,然后从此演绎出许多描述物质平衡性质的关系式。
热力学第一定律是力学中机械能转换和守恒定律的延伸。若环境对体系作功W,体系又从环境吸热Q,则体系的内能增加ΔU为:
由于U是状态函数,才能写为全微分;而W 及Q随过程而有所不同,不能写为全微分。
热力学第二定律指出了过程方向,它的一种表达方式便是熵增原理:
式中dS(体)、dS(环)及dS(总)分别表示体系、环境和总熵的全微分;(2)式中“=” 表示平衡关系;“>” 表示过程方向。熵的概念是在19世纪研究热机效率时提出的:从状态 1到状态 2的热量变化是随途径而异的,而可逆过程的
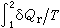 则与途径无关。人们定义熵S的全微分为:
则与途径无关。人们定义熵S的全微分为:δQr是可逆过程的热量变化,T是绝对温度,由于S是状态函数,故可写为全微分。
热力学第三定律是为了计算熵的绝对值的。凝聚系的熵在恒温过程中改变值ΔS 随绝对温度降低而趋于零。即:
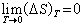 (4)从(3)式得到:
(4)从(3)式得到: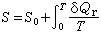 (5)从(4)式可以证明S0是一个绝对常数,一般选择S0=0。
(5)从(4)式可以证明S0是一个绝对常数,一般选择S0=0。热力学第一及第二定律分别引入体系的状态函数U及S,为了分析问题的方便,定义了焓H、自由能F及自由焓G
式中p及V分别是体系的压强和体积。合并第一及第二定律,可以获得关闭体系(与环境没有物质交换)的平衡条件(=)及过程方向(<)为:
由于p、V、T、S、U、H、F、G都是状态函数,借助于微分方程,可以导出许多表述物质平衡现象的关系式。例如,考虑可逆过程的膨胀功(pdV),则合并第一定律(1)式及第二定律(3)式得到:
利用上式及H、F、G定义,可以分别得到:
若再考虑可逆过程的其他功(下表),
 则与-pdV 相对应的有F·dι、γdA、εdZ、H·dJ,因而广义焓的定义为:
则与-pdV 相对应的有F·dι、γdA、εdZ、H·dJ,因而广义焓的定义为: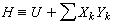 (17)式中YK为与体系的物质总量无关的“强度性质”,如表中p、F、γ、ε、H;XK为与体系的物质总量有关的“广度性质”,有时将YK和XK分别叫作“广义力”和“广义位移”。因此
(17)式中YK为与体系的物质总量无关的“强度性质”,如表中p、F、γ、ε、H;XK为与体系的物质总量有关的“广度性质”,有时将YK和XK分别叫作“广义力”和“广义位移”。因此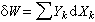 (18)
(18)
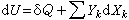 (19)利用(19)式及附表,可以处理广泛的物理和化学现象。
(19)利用(19)式及附表,可以处理广泛的物理和化学现象。由于在液态和固态金属的研究中,p和V常变化较小,可以忽略不计,所以G和F的判据常可互换使用。
经典热力学是热学的一部分,而热学的特有实验技术是测温(T)及量热(Q)。从(6)及(11)式得到:
若体系只作可逆膨胀功(-pΔV),则在恒压(Δp=0)下的热效应Qp便是ΔH:
恒压下热容Cp,即使体系升高1℃所需的热为:
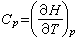 (21)
(21)Cp易于测定,一般具备如下形式:
化学热力学 化学热力学研究体系化学变化过程的热力学问题。应用经典热力学处理化学问题时,需要两个新的概念:成分和相。一般用摩尔数ni或摩尔分数xi来表示组元的成分:
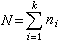 (24)
(24) (25)式中N 为k元系中摩尔总数。引入i组元的化学势μi:
(25)式中N 为k元系中摩尔总数。引入i组元的化学势μi: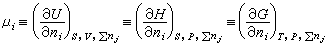 (26)式中括号外右下角的
(26)式中括号外右下角的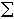 nj表示除i组元外,其他组元都不变的情况。在k元系中两相(A+B)平衡时,每一个组元在 A 及 B 相中的化学势必须相等:
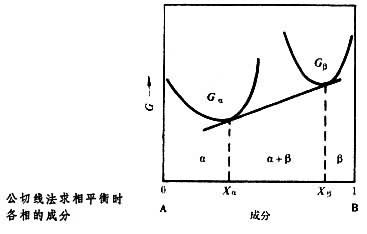
nj表示除i组元外,其他组元都不变的情况。在k元系中两相(A+B)平衡时,每一个组元在 A 及 B 相中的化学势必须相等:对于二元 (A及B)系中的两相(A 和B)平衡,可用下页图所示的公切线图解法求出平衡时A相的成分xa和B相的成分xB。
化学势也可用于判断过程的方向,当:
则i组元可自发地从A相迁移到B相。
对于如下的化学反应:
式中A,B,……是反应物,L,M,……是反应产物;a,b,……及ι,m,……分别是A,B,……L,M,……的摩尔数,可以证明,恒温恒压平衡时(ΔGm=0)的关系为:
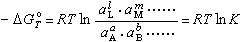 (30)式中ΔG孏是温度为T时标准自由焓变化,aΑ,aB,……,aL,aM……分别是A,B,……L,M,……的活度;K叫作平衡常数。因此,知道了ΔG孏及反应物的活度,便可计算反应产物的活度,从而知道过程进行的程度。活度a也称为有效浓度:
(30)式中ΔG孏是温度为T时标准自由焓变化,aΑ,aB,……,aL,aM……分别是A,B,……L,M,……的活度;K叫作平衡常数。因此,知道了ΔG孏及反应物的活度,便可计算反应产物的活度,从而知道过程进行的程度。活度a也称为有效浓度:式中γi是活度系数,可以实验测定。
统计热力学 热力学的优点是它的高度可靠性和应用的普遍性。但它不考虑物质的结构,不给出物质的具体知识,它只是一种宏观的现象理论。统计热力学正好弥补了热力学的这个缺点,它从体系的具体结构,去计算热力学函数。例如,利用下式可以计算体系的组态熵:
式中k是玻耳兹曼常数,W是热力学几率或叫状态数。又例如:
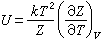 (34)
(34)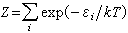 (35)式中Z是配分函数(英文为Partition function,德文为Zustands-summe,后者意为状态和);εi 为 i 态能量。因此,借助于(32)~(35)式,可从体系的结构去计算S、Z、F及U。例如,可以计算原子占据晶格阵点的组态熵,以及各种微观粒子(分子、原子、电子等)和能量单元(声子、光子、磁子等)分布所导致的运动熵。
(35)式中Z是配分函数(英文为Partition function,德文为Zustands-summe,后者意为状态和);εi 为 i 态能量。因此,借助于(32)~(35)式,可从体系的结构去计算S、Z、F及U。例如,可以计算原子占据晶格阵点的组态熵,以及各种微观粒子(分子、原子、电子等)和能量单元(声子、光子、磁子等)分布所导致的运动熵。典型问题举例 合金热力学所研究的课题不断在发展,现举例介绍其思路如下:
平衡结构 主要解决合金内部几个组元之间达到平衡时的结构形式,例如,是形成理想固溶体,或有序固溶体,还是形成金属间化合物等等(见合金相)。
在处理平衡结构问题时,可依据具体情况,选择(9)~(12)式的平衡判据。一般都用自由能 F来描述变化的平衡,以(11)式为平衡判据,并以自由能为最小作为变化的平衡条件。具体步骤如下:选定所要研究的成分或结构参量X(例如饱和固溶体的成分,有序固溶体的有序度,纯金属的空位饱和浓度,晶界区的平衡浓度,磁畴壁的厚度等)然后计算U和S与X的关系,代入(7)式,得到:
利用平衡系统的自由能为最小的条件:
便可从(37)式求出平衡时X和T的关系。
以二元代位固溶体为例。由统计物理学公式(32),可以得出系统的摩尔混合熵(组态熵)Sm:
式中XΑ、XB分别为A和B组元的摩尔分数;R为气体常数。
当已知固溶体的结构为完全无序排列,用统计物理方法还可计算二元固溶体内能变化:
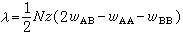 (41)对凝聚系ΔUm=ΔHm(ΔHm为溶解热),式中λλ为原子间交互作用参数,可由实验测定。N为阿伏加德罗常数,z为晶体中原子的配位数,wAB、wAA、wBB分别代表异类原子及同类原子间的键能,于是根据(39)式及(41)式,可得二元规则固溶体的混合自由能:
(41)对凝聚系ΔUm=ΔHm(ΔHm为溶解热),式中λλ为原子间交互作用参数,可由实验测定。N为阿伏加德罗常数,z为晶体中原子的配位数,wAB、wAA、wBB分别代表异类原子及同类原子间的键能,于是根据(39)式及(41)式,可得二元规则固溶体的混合自由能:整个固溶体的自由能与纯组元自由能FΑ、FB关系为:
令XΑ=X,则XB=1-X,并利用上式及(11)式,可得:
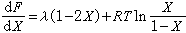 (44)
(44)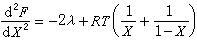 (45)根据(44)和(45)式,由λ≤0或λ>0,可判断合金固溶体在平衡状态的性质:
(45)根据(44)和(45)式,由λ≤0或λ>0,可判断合金固溶体在平衡状态的性质:当 λ=0,即
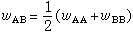 ,表明异类原子间的键能等于同类原子键能,合金为理想固溶体。
,表明异类原子间的键能等于同类原子键能,合金为理想固溶体。当 λ<0,即
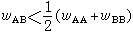 ,表明异类原子间的键能小于同类原子间的键能,异类原子容易偏聚。在组元间电化学因素相差较小的情况下,合金在低温下倾向于形成有序固溶体(或称超点阵)。如组元间电化学因素相差较大,则合金倾向于形成金属间化合物。 当 λ>0,即
,表明异类原子间的键能小于同类原子间的键能,异类原子容易偏聚。在组元间电化学因素相差较小的情况下,合金在低温下倾向于形成有序固溶体(或称超点阵)。如组元间电化学因素相差较大,则合金倾向于形成金属间化合物。 当 λ>0,即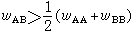 ,可分三种情况:①当2RT>λ>0,溶液仍为单相固溶体;②当λ=2RT,
,可分三种情况:①当2RT>λ>0,溶液仍为单相固溶体;②当λ=2RT,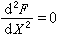 ,此时为形成两个固溶体的临界分层点;③当λ>2RT,
,此时为形成两个固溶体的临界分层点;③当λ>2RT,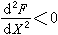 ,此时体系将开始形成以A或B为基的两个固溶体,形成相区界限。
,此时体系将开始形成以A或B为基的两个固溶体,形成相区界限。令(44)式为零,则
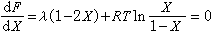 ,可以得到二元稀固溶体的饱和固溶度x与绝对温度T的关系,即:
,可以得到二元稀固溶体的饱和固溶度x与绝对温度T的关系,即: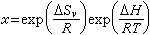 (46)式中ΔH是溶解热;ΔSv是溶解时振动熵的变化。从相图得到Fe3C在a铁中的固溶度实验数据:
(46)式中ΔH是溶解热;ΔSv是溶解时振动熵的变化。从相图得到Fe3C在a铁中的固溶度实验数据: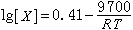 (47)对比上列二式便可得到:溶解热ΔH=9700cal/mol(原子),而从0.41可以计算振动熵的变化ΔSv。
(47)对比上列二式便可得到:溶解热ΔH=9700cal/mol(原子),而从0.41可以计算振动熵的变化ΔSv。失稳条件 恒温恒压下,状态失稳的必要条件是自由焓的下降,即ΔG<0[(12)式]。以液-固结晶为例,若在液相中形成半径为r的球形晶核,并以液相为参考态,则这时的G 为:
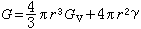 (48)式中Gv是单位体积液相转变为固相的自由焓变化,凝固时 Gv为负值;γ 是单位面积固液界面的能量,叫做表面张力或比界面能,为正值。求G 对r的一阶及二阶导数:
(48)式中Gv是单位体积液相转变为固相的自由焓变化,凝固时 Gv为负值;γ 是单位面积固液界面的能量,叫做表面张力或比界面能,为正值。求G 对r的一阶及二阶导数: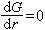 (49)这时的r记为*:
(49)这时的r记为*: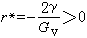 (50)这时的G 记为G:
(50)这时的G 记为G: (51) 而
(51) 而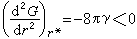 (52)因此,G随r的变化,在r*处有一个极大值,当r≥r*后, r的继续增大,才会使G继续下降。这里的r*叫做晶核的临界尺寸,G*叫做形核功。这个状态的失稳条件便是(49)及(52)式。
(52)因此,G随r的变化,在r*处有一个极大值,当r≥r*后, r的继续增大,才会使G继续下降。这里的r*叫做晶核的临界尺寸,G*叫做形核功。这个状态的失稳条件便是(49)及(52)式。恒容绝热时,状态失稳的必要条件是内能的下降,即ΔU<0[(9)式]。以裂纹体的裂纹失稳扩展导致断裂为例,可导出格里菲思(A.A.Griffith)断裂理论的基本方程式(见断裂力学)。
过程进度 应用(30)式,可以研究反应的进行程度。例如,考虑奥氏体(γ)转变为马氏体(M)的相变,转变温度(Tr)愈低,ΔG
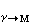 愈负,则形成的马氏体量的体积分数(f)愈多。
愈负,则形成的马氏体量的体积分数(f)愈多。合金热力学的能量分析方法,可以用来分析合金及其他材料的结构、性能和过程,而这三者,正是合金研究的主要问题。
参考书目
徐祖耀:《金属材料热力学》,科学出版社,北京,1981。
肖纪美:《合金能量学》,上海科学技术出版社,上海,1983。