吉布斯函数(卷名:物理学)
Gibbs' function
又称热力势、自由焓、吉布斯自由能等,是热力学中为便于研究等温等压过程而引入的一个态函数。它在等温等压过程中的减少量表征热力学系统在此过程中对外最多可能作多少非体积变化的功。它可作为不可逆等温等压过程进行方向和系统是否达到平衡态的判据。通常以符号G表示,其定义式为
G=U-TS+pV, (1)式中U、S、p、V和T分别为该系统的内能、熵、压强、体积和热力学温度(见热力学温标)。
由式(1)、热力学第一定律和熵增加原理可得
 (2)此式表明,在等温等压过程中系统对外所作的非体积变化的功等于(对可逆过程)或小于(对不可逆过程)其吉布斯函数的减少量。或者说,吉布斯函数的减少量等于系统在等温等压过程中对外所作非体积功的最大值。
(2)此式表明,在等温等压过程中系统对外所作的非体积变化的功等于(对可逆过程)或小于(对不可逆过程)其吉布斯函数的减少量。或者说,吉布斯函数的减少量等于系统在等温等压过程中对外所作非体积功的最大值。如果系统只可能作体积功而不能作非体积功,则有
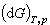 ≤0,对于不可逆过程逆过程
≤0,对于不可逆过程逆过程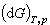 <0。 (3)此式表明,当系统对外不作非体积功时,不可逆等温等压过程只能向吉布斯函数减少的方向进行。当吉布斯函数减少到最小值时,系统达到平衡态,此时吉布斯函数不再变化。故
<0。 (3)此式表明,当系统对外不作非体积功时,不可逆等温等压过程只能向吉布斯函数减少的方向进行。当吉布斯函数减少到最小值时,系统达到平衡态,此时吉布斯函数不再变化。故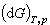 =0是系统处于平衡态的标志。
=0是系统处于平衡态的标志。化学中许多化学反应过程和物理学中的相变过程都是在等温等压条件下发生的,故吉布斯函数在这些领域中应用很广。化学中又常称吉布斯函数为自由能。