多相催化动力学(卷名:化学)
kinetics of heterogeneous catalysis
研究在相接触面上发生的催化反应速率和反应机理的物理化学分支学科。多相催化反应大致可分为七个步骤:①反应物质从反应相穿过催化剂颗粒表面外的反应相膜,扩散到催化剂外表面;②反应物质从催化剂颗粒外表面通过毛细管扩散到催化剂内表面;③在催化剂内表面上被吸附;④在催化剂内表面上进行反应;⑤反应生成物在催化剂内表面上脱附;⑥生成物通过毛细管扩散到催化剂颗粒外表面;⑦生成物通过催化剂颗粒表面外的反应相膜扩散到反应相中。催化剂的活性和选择性由催化剂的表面反应决定。
表面反应机理 表面反应速率rs是催化剂表面上的反应物(或生成物)浓度随时间的变化率,但表面浓度的测定方法尚不成熟,测定精确度较差,因此常用测定多相反应速率的方法求得。多相反应速率rh可由测定反应物(或生成物)浓度随时间的变化来得到。但只有在反应体系稳定之后,实测的反应速率才能代表表面反应速率。
在理想条件下,表面反应机理有以下三种:
①在动力学区进行的单分子表面催化反应机理:

式中A为反应物;S为吸附剂表面吸附部位;AS为被吸附物;P为产物。反应速率rh=k2KcA/(1+KcA),式中K=k+1/(k-1+k2),k+1、k-1、k2分别为反应速率常数,c为浓度。
②两种反应物分子都吸附在催化剂表面上进行反应的机理,称朗缪尔-欣谢尔伍德机理:


式中K为平衡常数。
③在催化剂表面吸附的分子A与反应相中分子B反应生成P的机理:


反应速率方程 在一般情况下,反应速率方程有如下形式:
①平衡反应:

平衡常数K等于正反应和逆反应的活性比:

②平行反应:

若这一对反应级数相同,并且发生在催化剂的两种不同类型的吸附位上,则:

③竞争反应:

若A、A′与B的反应级数都为1,则:

式中x、x′分别为A和A′的转化率。
④一级连续反应:

式中X为共同反应物。中间化合物B的浓度为:

式中
 ,
, 为反应物A的初始浓度。
为反应物A的初始浓度。经验动力学方程 上述反应速率方程是在表面均匀,不受扩散制约,吸附分子不解离的前提下给出的。但实际上催化剂的表面不均匀,同种分子在不同晶面上的催化活性和吸附热不同,吸附热随表面覆盖度的增加而下降,有扩散制约和分子间相互作用。因此,反应速率方程更复杂,有些只能用经验方程。
对A+B─→R+S反应,若正反应速率大于逆反应速率,p为物质浓度或压力,k+1、k-1为正逆反应速率常数,则反应速率
 。若不能忽略逆反应,则r=
。若不能忽略逆反应,则r= …。通过实验可求出a、b、l、m、a′、b′、l′、m′。
…。通过实验可求出a、b、l、m、a′、b′、l′、m′。扩散制约的反应 流体在多孔催化剂中的扩散分为三种。容积扩散是在孔径较大、气体较密集时发生的。容积扩散系数
 ,堸为分子平均速率,λ为分子平均自由程。微孔扩散是在孔径较小、气体密度低时发生的。微孔扩散系数
,堸为分子平均速率,λ为分子平均自由程。微孔扩散是在孔径较小、气体密度低时发生的。微孔扩散系数 ,R为孔半径。表面扩散是由于被吸附分子由高浓度向低浓度的热运动扩散而产生的。表面扩散系数为
,R为孔半径。表面扩散是由于被吸附分子由高浓度向低浓度的热运动扩散而产生的。表面扩散系数为 。可以看出,表面扩散主要取决于扩散温度T和表面活化能ES。
。可以看出,表面扩散主要取决于扩散温度T和表面活化能ES。扩散成为控制步骤的反应称扩散区反应,又可分为外扩散区反应和内扩散区反应。表面反应成为控制步骤的反应称动力学区反应,又可分为外动力学区反应和内动力学区反应。
①外扩散制约的反应的反应速率方程为:
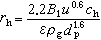
式中B1为气体反应物特征常数,
 ;ρ 为气体密度;μ为气体粘度;D为气体扩散系数;ρg为颗粒相对密度;u为催化剂床层中气体的表面线速度;dp为催化剂球形颗粒直径;ch为气相中反应物浓度;ε为孔隙率。
;ρ 为气体密度;μ为气体粘度;D为气体扩散系数;ρg为颗粒相对密度;u为催化剂床层中气体的表面线速度;dp为催化剂球形颗粒直径;ch为气相中反应物浓度;ε为孔隙率。②内扩散制约的反应:
扩散系数

式中
 称蒂勒模数;R为球颗粒半径;ki为本征速率常数;De为孔中反应物有效扩散系数;s为比表面;rp为内扩散制约的反应速率;rS为球形催化剂颗粒表面上的一级反应速率。
称蒂勒模数;R为球颗粒半径;ki为本征速率常数;De为孔中反应物有效扩散系数;s为比表面;rp为内扩散制约的反应速率;rS为球形催化剂颗粒表面上的一级反应速率。当η=1时,比反应速率(每克催化剂上的反应速率)r为:

cs式中cs为颗粒外表面附近的反应物浓度。由式中可看出,为提高催化效率,应减小dp、ρg和加大De。
③表面扩散制约的反应,当反应气体分子已进入微孔扩散时,表面扩散对催化影响很小。若反应分子大,催化剂孔径小,二者接近同一数量级,则表面扩散对反应活性影响很大。
多相催化反应条件的优化 最优转化率 高转化率可提高原料利用率,但增加了催化剂用量,须增加反应器容积和空间速率。在生产能力、温度、压力和初始浓度固定时,转化率、空间速率、反应器容积三者只有一个可任意选择。
最优反应温度 对于不可逆反应,温度只对反应速率有影响,其影响服从阿伦尼乌斯方程。对于可逆吸热反应,平衡常数K和反应速率常数k 均随温度升高而增大。对于可逆放热反应,温度增加,转化率降低,但反应速率增加,因而净反应速率随温度的变化有一最优值。
最优反应压力 对于气相反应:

 。压力对平衡转化率的影响为:Δv>0时,压力提高,转化率下降;Δv<0时,压力提高,转化率增加;Δv=0时,压力对转化率无影响。压力对反应速率的影响为:对于扩散控制的反应,压力直接影响反应速率;对于动力学控制的反应,压力不大时,对吸附平衡和反应速率常数的影响可忽略不计。
。压力对平衡转化率的影响为:Δv>0时,压力提高,转化率下降;Δv<0时,压力提高,转化率增加;Δv=0时,压力对转化率无影响。压力对反应速率的影响为:对于扩散控制的反应,压力直接影响反应速率;对于动力学控制的反应,压力不大时,对吸附平衡和反应速率常数的影响可忽略不计。最优反应物浓度 对于
 反应,当反应接近平衡时,最优浓度
反应,当反应接近平衡时,最优浓度 ;当反应远离平衡时,最优浓度
;当反应远离平衡时,最优浓度 ;当反应在远离平衡和接近平衡之间时:
;当反应在远离平衡和接近平衡之间时:
式中n、m等为速率方程
 中之相应符号,nL为控制步骤的化学计算数。
中之相应符号,nL为控制步骤的化学计算数。