热力学第二定律(卷名:化学)
second law of thermodynamics
也称能量耗散定律,是热力学中关于过程进行的方向性的定律。基本内容可以概括为:凡涉及热现象的过程都是不可逆的;而且不可逆过程所产生的效果,不论用任何办法,都不能完全恢复原状而不引起其他变化。
热力学第二定律是一条经验定律,因此有许多种表述方式,最早的表述方式分别由德国物理学家R.克劳修斯于1850年和英国物理学家开尔文于1851年提出。
热力学第二定律并不能从任何其他自然定律推导出来,它的正确性是由它的推论都与实际现象相符而得到验证的。正因为这个原因,热力学第二定律的结论有普遍适应性。
可逆过程和不可逆过程 可逆和不可逆的概念在热力学第二定律中有至关重要的作用。所谓可逆过程是指这样一种过程:每一步都可在相反的方向进行,而不在环境中引起其他变化;也就是说,当在与原方向相反的方向进行时,系统和环境在过程中每一步的状态都是原来正向进行时状态的重演。相应地,不符合这个条件的过程是不可逆过程。
只有无限缓慢的、系统始终无限接近于平衡态的过程(称为准静态过程)才能是可逆的。因此,可逆过程仅是一种理想化的过程,实际过程都不是可逆的。这表现为自然界中的各种事件总是自发地向单一的方向发展。例如,当两个温度不等的物体接触时,低温物体总是自动地从高温物体吸收热量,而高温物体不会自动地从低温物体吸收热量;当两种气体放入一个孤立的容器中时,它们总是自发地趋于均匀混合的状态,而一旦混合以后就不会自发分开。化学反应在确定的条件下也总是向确定的方向进行。正是从大量的事实中,才得出以下结论:所有的自发过程都是不可逆的。这一结论构成了热力学第二定律的基础。
热机和制冷机 历史上,热力学第二定律的发现主要基于法国工程师S.卡诺的理想热机工作原理。所谓热机是指通过循环过程把热能转换为机械能的装置或系统,例如蒸汽机和内燃机。所谓循环过程是指始态和终态相同的过程。
卡诺在总结了热机工作过程的最本质的内容后,于1824年发表了“关于火的动力和发展这种动力的合适机器的感想录”的论文,指出:热机必须工作于两个热源之间,从高温热源吸收热量,又把吸收的部分热量释放给低温热源,只有这样,才能把从高温热源吸收的部分热量转化为有用的机械功。
热机对外做的功W 和它从高温热源吸收的热量Q1之比,称为热机的效率(记作η):
η=W/Q1 (1)如果把热机向低温热源放出的热量记作Q2,则利用热力学第一定律,可将式(1)写作:
η=1-Q2/Q1 (2)
如果把热机的工作过程反向进行,有可能把热量从低温热源传到高温热源,但与此同时,必定要消耗机械功(或其他功,如电功)。这种通过消耗机械功(或其他功)把热量由低温热源传到高温热源的装置称为制冷机。制冷机的工作性能可以用下式定义的工作系数 ε来表征:
ε=Q2/W (3)式中Q2是从低温热源吸收的热量;W是外界做的功。
卡诺循环和卡诺定理 卡诺在他的1824年的论文中引入了后来以他的姓命名的循环──卡诺循环──概念,这一概念在热力学第二定律的历史发展中起过极为重要的作用。
卡诺循环由下列四步可逆过程组成(见图,
 其中p和V分别代表系统的压力和体积):①具有固定质量的工作物质从温度为t1的状态A出发,作绝热膨胀,沿曲线AB到达温度为t2的状态B;②从状态B出发,作等温压缩,沿曲线BC到达状态C,其间向低温热源(冷凝器)放出热量Q2;③从温度为t2的状态C出发作绝热压缩,沿曲线CD到达温度为t1的状态D;④从状态D出发,作等温膨胀,沿曲线DA回到状态A,其间从高温热源吸收热量Q1。
其中p和V分别代表系统的压力和体积):①具有固定质量的工作物质从温度为t1的状态A出发,作绝热膨胀,沿曲线AB到达温度为t2的状态B;②从状态B出发,作等温压缩,沿曲线BC到达状态C,其间向低温热源(冷凝器)放出热量Q2;③从温度为t2的状态C出发作绝热压缩,沿曲线CD到达温度为t1的状态D;④从状态D出发,作等温膨胀,沿曲线DA回到状态A,其间从高温热源吸收热量Q1。在循环过程终了时,工作物质回到原来的状态。一个循环过程总的效果是工作物质从高温热源吸收了热量Q1,向低温热源放出了热量Q2,同时对环境做了功W(图中曲线内的面积)。W 和Q1之比即为循环的效率。
卡诺循环属于可逆循环。如果仅仅给定两个热源的温度,可以实现多种不同大小的卡诺循环,还可以实现各种各样的非卡诺循环(不可逆循环)。不同的循环可以具有相同的或不同的效率。卡诺在1824年的论文中指出:所有工作于两个一定温度的热源之间的循环,以可逆循环的效率最高。这就是有名的卡诺定理。
从卡诺定理可以得到一个重要的推论:所有工作于两个一定温度的热源之间的卡诺循环的效率相同。
根据上述推论,开尔文于1848年定义了一种与工作物质的性质无关的热力学绝对温标(见热力学温标)。对于可逆循环,高温热源与低温热源的热力学温度(记作T1和T2)与Q1和Q2之间满足如下关系:
Q2/Q1=T2/T1 (4)从式(2)和式(4)以及卡诺定理,应有:
η≤1-T2/T1 (5)式中等号适用于可逆循环过程。如果规定吸收的热量为正,放出的热量为负(即将Q2记作-Q2),则从式(2)和式(5)可得到:
Q1/T1+Q2/T2≤0 (6)推广到依次与n个热源接触的循环过程,可有:
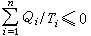 (7)式中Qi为系统从温度为Ti的第i个热源吸收的热量。对于更普遍的循环过程,式(7)应写作:
(7)式中Qi为系统从温度为Ti的第i个热源吸收的热量。对于更普遍的循环过程,式(7)应写作: (7′) 式中 δQ为系统从温度为T的热源吸收的微热量。式(6)、(7)或(7′)是有名的克劳修斯不等式。
(7′) 式中 δQ为系统从温度为T的热源吸收的微热量。式(6)、(7)或(7′)是有名的克劳修斯不等式。热力学第二定律的表述方式 克劳修斯和开尔文对卡诺定理进行分析后,分别于1850年和1851年得出了热力学第二定律的两种表述方式。
克劳修斯表述 不可能把热量从低温物体传到高温物体而不产生其他影响。
开尔文表述 不可能从单一热源吸取热量使之完全变为功而不产生其他影响。
这两种表述虽然表面上很不相同,但本质上是相同的。它们都反映了自发过程的不可逆性。克劳修斯表述反映了传热过程的不可逆性,而开尔文表述反映了热功转换过程的不可逆性。可以证明,这两种表述是完全等价的。
卡拉西奥多里表述 在一个物体体系的任一给定的平衡态的附近总有这样的态存在,从给定的态出发不可能经绝热过程到达。
路易斯-兰德尔表述 实际发生的过程都是不可逆过程。
在20世纪40年代以来的许多文献中,热力学第二定律有更详细的表述:对于任何一个宏观系统,存在一个状态函数S,叫做熵。如果系统由几个部分组成,则总熵等于每一部分的熵的和。熵的变化可表示为两部分之和:
dS=deS+diS (8)式中 deS表示由与外界的相互作用引起的对系统的熵变的贡献; diS表示由系统内部的变化过程对熵变的贡献,即由系统内部产生的熵。diS永远不会是负值。当系统发生可逆变化时,diS等于零;而当系统发生不可逆变化时,diS大于零,因而
diS≥0 (9)对于与外界既不能交换物质又不能交换能量的孤立系统,deS=0,因而从式(8)和式(9)可得:
dS≥0 (10)这是热力学第二定律通常的数学表示形式。对于那些能与外界交换热量但不能交换物质的封闭系统,可有:
deS=δQ/T (11)式中δQ为系统从外界吸收的热量。故对封闭系统,可有:
dS≥δQ/T (12)这是热力学第二定律的又一种通常的数学表示形式。而不等式 (9)可以看作是热力学第二定律最一般的数学表示形式。
第二类永动机 在热力学第一定律确立以前,人们曾幻想制造一种机器,这种机器可以不需要外界供给能量而能不断地对外界做功。这种幻想的机器称为第一类永动机。热力学第一定律的确立,宣告了这类永动机是不可能造成的。在此之后,又有人幻想制造出一种机器,这种机器可以从单一热源取热,使之完全变为有用的功而不产生其他影响。如果这类机器可以造成,则可以无限制地从单一热源(例如海洋)取热而不停地做动。这类机器称为第二类永动机。第二类永动机并不违反热力学第一定律,但是违反热力学第二定律。因此热力学第二定律的确立,宣告了第二类永动机也是不可能造成的。事实上,热力学第二定律本身有时被说成是:第二类永动机是不可能造成的。
热力学第二定律的本质和限制 严格地说,所谓“一个过程是不可逆的“ 并不意味着这一过程的逆过程是绝对不可能发生,而只是指发生这种逆过程的几率非常非常小。因此热力学第二定律的本质是:一切不可逆过程皆是系统从一种几率小的状态变到几率大的状态的过程。热力学第二定律的这种本质解释最早是由奥地利物理学家L.玻耳兹曼作出的。
因为关于几率的讨论只适用于由很多结构单元(原子、分子……)组成的体系,因此只有对于由很多结构单元组成的体系,热力学第二定律的结论才是适用的。
参考书目
F. O. Koenig, On the Various Statement of the Second Law of Thermodynamics,Survey of Progressin Chemistry,Vo1.7, Academic Press,New York,1976.