磷(卷名:化学)
phosphorus
一种化学元素,化学符号 P,原子序数15,原子量30.973762,属周期系VA族。1669年德意志 H.布兰德从尿中制得。元素英文名来自希腊文phōsphores,原义是“发光物”。
存在 磷在地壳中的含量为0.118%(重量)。自然界中含磷的矿物有磷酸钙 Ca3(PO4)2、磷灰石Ca5F(PO4)3等,磷还存在于细胞、蛋白质和骨骼中。在自然界中只有一种稳定的同位素磷31。
物理性质 磷有白磷、红磷、黑磷三种同素异形体。
白磷的熔点 44.1℃,沸点280℃,20℃时的密度为1.82克/厘米3。白磷为白色至黄色固体(决定于纯度),故又叫黄磷。它质软似蜡状,反应活性很高,在空气中能自燃形成P4O10,必须储存在水中。白磷不溶于水,毒性很大,人体吸入0.1克白磷,就会中毒死亡,空气中白磷的容许浓度是0.1毫克/米3。白磷能中等程度地溶解在二甲醚和苯中;低于800℃时,无论固态、液态或气态都是以P4的形式出现,它是四面体结构。
白磷在没有空气的条件下,加热到250℃或者在光照下,就转变为红磷。红磷与白磷不同,它不溶于水也不溶于二硫化碳。红磷无毒,加热到400℃以上才着火。在高温下红磷与一些元素的反应与白磷相同,但反应能力差一些。红磷呈链状结构。
在高压下,白磷可转变为黑磷。它是具有层状的网络结构,能导电,是磷同素异形体中最稳定的。
化学性质 磷的电子构型为(Ne)3s23p3,氧化态为+5、+4、+3、-3、+1。磷可与电负性低的原子结合而形成P3-离子的离子型化合物,P3-离子仅存在于固体中,在水溶液中,P3-离子会发生水解作用,例如:
Ca3P2+6H2O─→3Ca(OH)2+2PH3在磷的共价型化合物中,磷的氧化态可从+5变化到-3。P(Ⅲ)原子上有一孤对电子,它可以向一些过渡金属离子进行配位,生成膦类的配位化合物。
如果氧气不足,在潮湿的情况下,白磷氧化很慢,并伴随有磷光现象。当白磷溶于热的浓碱溶液时,生成磷化氢和次磷酸二氢盐,例如:
P4+3KOH+3H2O─→PH3+3KH2PO2
干燥的氯气与过量的磷反应生成三氯化磷,当磷与过量的干燥氯气反应则生成五氯化磷。磷在充足的空气中燃烧可生成五氧化二磷P4O10(过去沿用P2O5),如果空气不足则生成三氧化二磷P4O6(过去沿用P2O3)。将它们溶于水时发生下列反应:
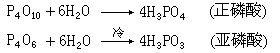 P4O10溶于水时,用水量多时可生成正磷酸;用水量少时则生成各种聚合度的偏磷酸,例如:
P4O10溶于水时,用水量多时可生成正磷酸;用水量少时则生成各种聚合度的偏磷酸,例如: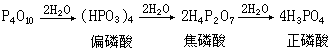 P4O10对水有很强的亲和力,甚至能从其他物质中夺取化合态的水,故常被用作干燥剂,例如:
P4O10对水有很强的亲和力,甚至能从其他物质中夺取化合态的水,故常被用作干燥剂,例如:P4O10+6H2SO4─→6SO3+4H3PO4
P4O10+12HNO3─→6N2O5+4H3PO4
制法 将磷酸钙、石英砂和炭粉混合物放在电孤炉中熔制,反应生成的磷蒸气通入水中就得到凝固的白磷:
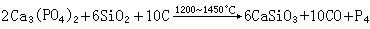
应用 约用三分之二的磷用于磷肥。磷还用于制造磷酸、烟火、燃烧弹、火柴、杀虫剂等。三聚磷酸盐用于合成洗涤剂。