燃烧量热学(卷名:化学)
combustion calorimetry
热化学的一个分支,是测定物质燃烧反应热效应的实验科学。这种热效应称作燃烧热。单位是千焦/摩尔。
测定燃烧热的方法一般分为定容和定压两种。根据热力学第一定律,定容燃烧热等于燃烧反应的内能变化ΔUc,定压燃烧热等于燃烧反应的焓变化 ΔHc,
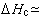
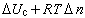 ,式中Δn为燃烧反应中气相物质增加的摩尔数;R为气体常数;T为反应温度。
,式中Δn为燃烧反应中气相物质增加的摩尔数;R为气体常数;T为反应温度。燃烧热与温度的关系可用基尔霍夫定律表示:
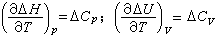 式中的下标p、V分别表示定压或定容过程;ΔC表示产物和反应物总热容之差。
式中的下标p、V分别表示定压或定容过程;ΔC表示产物和反应物总热容之差。燃烧热应指明相应的燃烧反应的热化学方程,其中反应物和产物都要标明它的状态,方程中的系数表示物质的摩尔数。按热力学规定,放热反应的热效应为负值。例如:H2(气,1大气压,25℃)+0.5O2(气,1大气压,25℃)=H2O(液,1大气压,25℃),ΔH懢=-285.830±0.042千焦/摩尔。
热力学中采用标准态作为参考态。标准态的燃烧热用ΔH懢或ΔU懢表示。标准态的燃烧反应是一个理想的过程,其反应物和产物分别处在各自的热力学标准态(见标准热力学函数)。
由于燃烧反应比较完全,热效应大且副反应少,燃烧量热法准确度高,适用范围广。燃烧热主要用来求出物质的生成焓。在工业上,燃烧热值是煤、石油等能源的一个重要质量指标。
历史 早在18世纪,A.-L.拉瓦锡就曾用冰量热计测量过燃烧热,以研究燃烧与呼吸的关系。19世纪中叶,H.P.J.J.汤姆森发展了火焰量热学,M.贝特洛开创了氧弹量热学的研究,目的是要定量地阐明化合物中元素的化学亲合势与化合物反应热的关系。后来热力学第二定律表明这一关系中还包括熵的效应。从此热效应和熵的实验测定都成了热化学研究的基本内容。在20世纪以前,燃烧热数据的准确性很差,原因是能量基准不一致。20世纪初,用准确测量的电能来标定量热计,使量热学数据统一在电能的基础上。但精密的电测量不易普及,1920~1921年,国际纯粹与应用化学联合会提出并通过决议,采用苯甲酸作标定氧弹量热计的热化学标准。从此用电能比较测量纯苯甲酸燃烧热的工作一直推动燃烧量热学向精密、准确方向发展。1956年出版《实验热化学》第一卷时,国际上几个实验室的测量结果落在平均值附近0.02%范围以内。

20世纪30年代,随着石油工业和石油化工的发展,新化合物的数目增长异常迅速,大大推动了热力学、动力学等的研究。同时,精密量热工作的基础正逐渐成熟,E.W.沃什伯恩建立了标准态更正方法,F.D.罗西尼在美国标准局重新开展了精密氧化焰量热学和氧弹量热学的研究,推动了现代精密热化学的研究,为基础研究和工业开发提供了大量的准确数据。
为了解决含硫、卤素等元素的有机化合物的燃烧终态不确定问题,1933年M.M.波波夫设计了摆动弹量热计,1946~1949年,S.孙纳尔,1954年美国W.N.哈伯德分别设计了转动弹量热计,为准确测定这类化合物的燃烧热开辟了新的途径。
在燃烧量热学方面的另一个突破,是用氟代替氧作氧化剂。1961年哈伯德等设计了氟弹量热计,1968年阿姆斯特朗等设计了氟火焰量热计,使氟化合物,特别是无机氟化物和低沸点有机氟化物的燃烧量热学研究达到新的水平。
燃烧量热学的发展与整个科学技术的进步和生产、国防的需求紧密相联系。目前它广泛应用于能源、化工、医药、农药、火药、炸药及推进剂、生物过程、特殊材料和基础科学等方面。
一般实验方法 燃烧量热计的结构通常分为体系和环境两部分。体系包括燃烧室、量热介质、容器、温度计和各种附属装置;体系以外称作环境。燃烧室分为定压和定容两类。定容(弹式)适合于固体和液体物质的燃烧;定压(火焰式)适合于气体或挥发性液体的燃烧。常用的量热介质是水,环境是一个恒温槽。量热用的温度计有:汞温度计(贝克曼型和量热学型)、热电偶堆、铂电阻、热敏电阻、石英温度计。温度测量的分辨率可达 0.0001K或更好。石英温度计和电阻温度计还可与数字显示仪和打印机联用。
燃烧量热实验一般分为三部分:能量测量、化学计算和标准态更正。
量热原理是在绝热条件下测量一定量物质燃烧产生的体系的温度升高,并与在绝热条件下已知能量引起的温度升高相比较。绝热条件下体系温度升高 1度所需的能量称作量热计的能当量,其测定方法有:①加入准确的电能法;②燃烧标准物质(例如苯甲酸)法。
实际测量的温度升高,必须对加入体系的功(如搅拌)及体系与环境间热交换的影响作更正。在仔细设计的量热计中,搅拌热必须恒定,热交换一般被尽可能地减小或消除,并近似地认为与体系对环境的温差成正比,即遵从牛顿冷却定律。连续测量燃烧前后体系温度的变化,可以计算这些更正值,从而得到绝热条件下体系的温度升高,然后由能当量计算燃烧过程的能量。
化学计量包括反应物(质量、纯度和杂质)和产物(成分、含量和状态)的计量分析,以确定燃烧反应量、反应完全性和副反应量。这些计算的准确度应与能量测量的要求一致。在更正各种副反应的能量后,可从燃烧过程的能量得到样品的燃烧热。
标准态的更正是把实验测定的燃烧热更正到标准态下的燃烧热。经过若干假想的过程,把反应物和产物分别从燃烧反应的实际状态转变到各自的标准态。这包括反应物或产物的压缩、混合、溶解、蒸发、稀释等或相反的过程。这些过程的能量和就是标准态更正值,一般很小。目前对含碳、氢、氧、氮、硫和卤素的有机化合物,更正所需要的热力学数据基本齐备,其计算已编成程序,可在计算机上进行。
燃烧量热学的研究内容及其典型仪器 氧弹量热学 氧弹是一种耐压的金属密封容器,内部充入约30大气压的氧气。大多数有机物在弹中能迅速、完全地燃烧,生成二氧化碳和水以及其他产物。氧弹量热计从结构上可分为:①静止氧弹量热计,有环境等温和绝热跟踪两类,工业上用于热值的测定,精密度可达0.1%~0.2%。图1是研究用的仪器,精密度可达0.01%左右。②转动氧弹量热计,除氧弹转动装置外,其余和静止氧弹量热计类似(图2)。根据需要,弹内可以加入一些试剂与燃烧产物进一步反应。转动氧弹可以增加反应速率和加速气液平衡,得到确定的终态。例如,燃烧含氯化合物时,弹中加入三氧化二砷溶液,与燃烧产物氯发生反应,最后得到均匀的盐酸溶液。
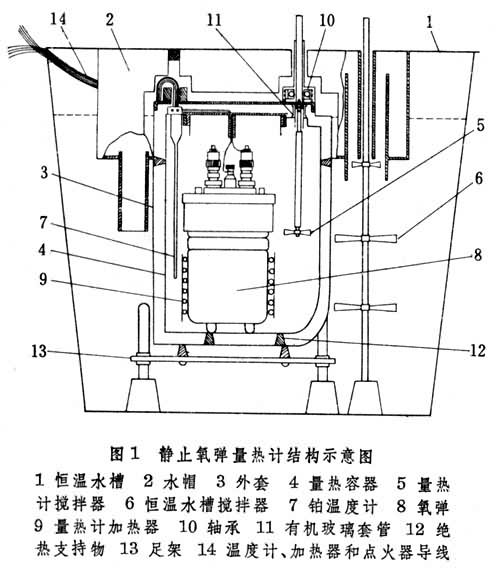
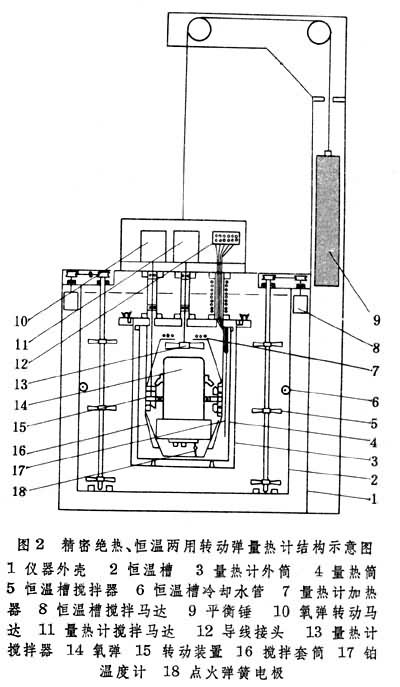
在氧弹量热学中,视研究对象所含元素的不同,燃烧技术、产物分析和标准态更正都将不同。为了核对各类物质测试方法的可靠性,已分别推荐了一些燃烧热已准确测定过的试验物质。
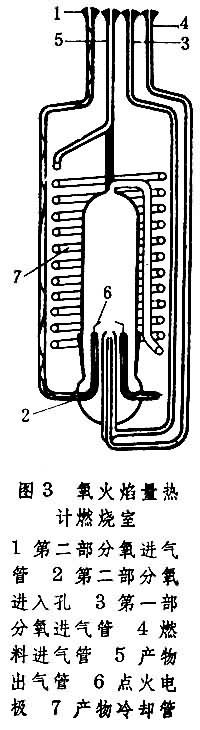
氧火焰量热学 分为连续气流和不连续气流两类,研究所用仪器的精密度约为0.01%,除燃烧室和供气系统外,其余与氧弹量热计类似。图3为燃烧室示意图,气体或蒸气(用氩气作载气)燃料与氧气在燃烧室内混合后燃烧,产生平稳火焰。产物恒温后流出量热计,通过产物分析进行化学计量。量热计可用电能法或氢和氧燃烧反应来标定能当量。推荐的试验物质是甲烷。研究对象包括含碳、氢和碳、氢、氧的有机化合物。对含氮和氯的化合物研究得很少,主要困难是不易燃烧完全和不易得到完全确定的终态。
氟弹量热学 一些物质在氧中燃烧不完全或生成物复杂,使测量不准确。如用氟(或其他卤素)代替氧作氧化剂,可以燃烧完全或形成单一含氟产物。但需要特别注意氟的腐蚀性和毒性。弹的结构有各种不同的设计,常分作单室的和双室的两种。双室氟弹适合于对氟敏感的物质,点火前把氟单独贮存在另一室中。对单室氟弹,建议用钨作试验物质,对双室氟弹建议用钨或硫作试验物质。研究对象有元素氟化物、元素氯(溴)化合物等。
氟火焰量热学 包括用氟或具有反应活性的氟化物、卤素等代替氧的火焰量热学研究。燃烧室分为单相和双相结构两类。单相结构中反应物和产物都是气体。但当产物中有氟化氢生成时,由于它的非理想性和实际气体热焓的不准确性,带来较大误差。双相结构使气体产物通过水溶液进一步反应,以克服上述缺点。单相仪器可用电能法标定,双相仪器可用氢和氧的燃烧反应标定。研究对象有:①氢-卤素反应;②卤素-氢-水反应;③卤素间化合物;④卤素氧化物;⑤卤素氮化物等。
展望 自动化和计算机的应用使量热工作比过去容易多了。当前燃烧量热学正继续向精密、准确和新化合物领域发展。在仪器方面,量热计小型化是一个发展动向,以便解决那些非常昂贵、难于合成或提纯、易于爆炸的化合物的测定。此外,为了避免搅拌水型结构的缺点,无液型量热计的研究也受到重视。在研究对象方面,当前对于含碳、氢、氧、氮的化合物已测得了大量的准确数据;对含硫和卤素的化合物,准确测定的方法已基本建立,但数据还有待积累。对其他化合物,特别是有机金属化合物的研究刚开始,许多重要的数据缺乏。目前影响测量准确性的困难仍然主要来自化学部分。应当指出,生成热数据除可用热化学实验测定外,原则上也可用量子化学计算。但除极简单的分子外,准确性都不如实验结果高。对于半经验的量子化学或分子力场计算来说,准确的量热结果始终是它们建立模型和检验结果的基础。
参考书目
S.Sunner and M.Mansson,Combustion Calorimetry, Pergamon, Oxford,1979.