氨(卷名:化学)
ammonia
化学式NH3。无色气体,有刺鼻臭味;熔点-77.7℃,沸点-33.35℃,密度0.7710克/升(760毫米汞柱);很容易溶于水和液化。氨分子中的氮原子是采用 sp3不等性杂化成键的,其中有一对孤对电子,另外三个电子与氢原子的 s电子结合成三个共价键。由于孤对电子的排斥作用,HNH键角是106.75°,氨分子的几何构型呈三角锥形。
化学性质 液态氨有微弱的电离作用:
2NH3
 NH嬃+NH娛
NH嬃+NH娛[NH嬃][NH娛]=1.9×10-33(在-50℃时)
液氨可作有机物的溶剂,比水优良。它还能溶解碱金属和钙、锶、钡,生成含有高度流动电子的蓝色溶液,这个溶液能传导电流,如:
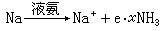 但不稳定,会逐渐褪色放出氢气,生成金属氨合物:
但不稳定,会逐渐褪色放出氢气,生成金属氨合物:
氨呈碱性,与酸作用生成盐;氨与大多数过渡金属(见过渡元素)离子如Zn2+、Cd2+、Ag+、Hg2+ 等以配位键的方式结合生成配位化合物。它还可作为还原剂,尤其在高温下很容易氧化,如:
4NH3+3O2─→2N2+6H2O
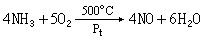
制法 工业制法:
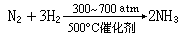 实验室制法:通常实验室制氨是用铵盐同强碱一起加热而得,也可由离子型氮化物水解而得,例如:
实验室制法:通常实验室制氨是用铵盐同强碱一起加热而得,也可由离子型氮化物水解而得,例如:NH4Cl+NaOH─→NH3+H2O+NaCl
Mg3N2+6H2O─→3Mg(OH)2+2NH3
应用 氨是生产硝酸、铵盐的主要原料,用于染料、医药、塑料、化肥等工业中,也可做洗涤剂、循环制冷剂。