离子迁移数(卷名:化学)
transference number of ions
各种离子在导电过程中各自的导电份额(以百分数表示)。例如,对于0.1N 盐酸来说,总电流的83.1%是由 H+承担的,16.9%是由Cl-承担的,因此H+的迁移数t
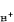 =0.831;Cl-的迁移数tCl-=0.169。显然,电解质溶液中所有离子迁移数的和应该是1。
=0.831;Cl-的迁移数tCl-=0.169。显然,电解质溶液中所有离子迁移数的和应该是1。迁移数可以通过实验测量,有了迁移数以后,便能求得离子的当量电导Λi。对于某一电解质,它的正、负离子的当量电导可分别写成:
Λ+=t+Λ Λ-=t-Λ在无限稀释条件下,迁移数可以用外推法求得。此时,离子淌度U与离子迁移数的关系为:
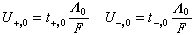 式中F为法拉第常数。
式中F为法拉第常数。表中列出了某些离子在无限稀释条件下的淌度 Ui,0,也称极限离子淌度。Ui,0 不受电解质中对应离子的影响,即它们是独立的,符合离子独立移动定律。

有了极限离子淌度就能根据下式:
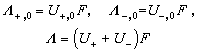 计算无限稀释条件下离子的当量电导和任何电解质的当量电导。例如,可以根据表中的
计算无限稀释条件下离子的当量电导和任何电解质的当量电导。例如,可以根据表中的 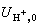 和
和 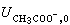 求得25℃时水溶液中乙酸的 Λ0=0.00402×96500=390.7厘米2/(欧·当量)。
求得25℃时水溶液中乙酸的 Λ0=0.00402×96500=390.7厘米2/(欧·当量)。表中还提供了不少关于离子在溶液中状态的信息。例如碱金属离子的晶体半径大小顺序为Li+<Na+<K+,但它们的淌度大小顺序恰好相反,说明了它们在水介质中不是单独移动,而是带着溶剂水分子一起移动。Li+半径很小,离子周围静电作用力很强,移动时带引的水分子最多,所以在电场作用下,Li+移动得最慢。卤素离子的半径较大,水化数小,它们的离子极限淌度都很接近。H+和OH-的Ui,0比一般离子大得多, 说明它们在溶液中的导电机理与一般离子大不相同。