电池(卷名:电工)
cell
将化学能、光能、热能、核能等直接转换为电能的装置。有化学电池、太阳电池、温差电池、核电池等。通常所说的电池指化学电池。
电池作为一种能源,目前已不仅限于一般的生活和生产中使用。随着生产力和科学技术的发展,人们对电池的性能提出了更多的要求,电池的功能和应用领域也在不断扩大。如储能电池,可储存夜间低负荷时剩余的电能,到高峰供电时再放出;高效率、低污染的燃料电池的发展有可能使目前的电能供需系统出现大的变化;新型军用电池可用于核武器的引信与遥测、导弹运载工具的点火和轨道修正以及炮弹的弹道控制和坦克的起动;空间探索和海洋开发也需要新型电池作为辅助电源。
电池的种类很多,常用电池主要是干电池、蓄电池,以及体积小的微型电池。此外,还有金属-空气电池、燃料电池以及其他能量转换电池如太阳电池、温差电池、核电池等。
电池的性能参数主要有电动势、容量、比能量和电阻。电动势等于单位正电荷由负极通过电池内部移到正极时,电池内非静电力(化学力)所作的功。电动势取决于电极材料的化学性质,与电池的大小无关。电池所能输出的总电荷量为电池的容量,通常用安培小时作单位。在电池反应中,1千克反应物质所产生的电能称为电池的理论比能量。电池的实际比能量要比理论比能量小。因为电池中的反应物并不全按电池反应进行,同时电池内阻也要引起电动势降,因此常把比能量高的电池称做高能电池。电池的面积越大,其内阻越小。
干电池 一种使用最广泛的化学电池。1865年法国人勒克朗谢(Leclanche) 在伏打电池的基础上研制了一种碳/二氧化锰/氯化铵溶液/锌体系的湿电池。 他把固体的二氧化锰装在陶器的杯子里,中间插上一根碳棒作为正极,然后将其放入装有氯化铵溶液的玻璃杯中,并在溶液中放—锌棒作负极。后来有人将锌棒改为锌筒,既作电池的负极又兼作容器,就成了目前常用的锌-锰干电池的形式。经过一百多年的发展,干电池现在已经有一百多种。除了锌-锰干电池外,还有镁-锰干电池、锌-氧化汞干电池、 锌-氧化银干电池等。由于干电池的氧化和还原反应的可逆性很差,用完后一般不能用充电方法使正、负极活性物质恢复到原来状态,因此干电池又称为一次电池。最常用的干电池是锌-锰干电池,有糊式、纸板式、碱式和叠层式几种。
糊式锌-锰干电池 由锌筒、电糊层、二氧化锰正极、炭棒、铜帽等组成。最外面的一层是锌筒,它既是电池的负极又兼作容器,在放电过程中它要被逐渐溶解;中央是一根起集流作用的碳棒;紧紧环绕着这根碳棒的是一种由深褐色的或黑色的二氧化锰粉与一种导电材料(石墨或乙炔黑)所构成的混合物,它与碳棒一起构成了电池的正极体,也叫炭包。在放电过程中,由于化学反应而生成的氢气泡会聚集在碳棒的周围从而增加了电池的内阻,这种现象称为极化作用。二氧化锰则作为氧化剂用来消除这些氢气泡,以降低电池的内阻,因此二氧化锰又称去极剂。在炭包与锌筒之间只有几毫米宽的间隙里是漂白色的糊状电解质,它是由氯化铵水溶液以及少量的氯化锌、微量的升汞以及淀粉所组成。微量的升汞与金属锌生成极薄的锌汞合金膜,可提高电池的防腐能力。为避免水分的蒸发,干电池的上部用石蜡或沥青密封。锌-锰干电池工作时的电极反应为
锌极: Zn─→Zn2+ +2e
碳极:
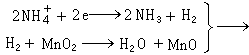
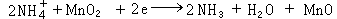
纸板式锌-锰干电池 是在糊式锌-锰干电池的基础上改进而成。它以厚度为 70~100μm的不含金属杂质的优质牛皮纸为基,用调好的糊状物涂敷其表面,再经过烘干制成纸板,以代替糊式锌-锰干电池中的糊状电解质层。由于纸板厚度仅有0.2mm,因而它的炭包中可以容纳更多的二氧化锰。二氧化锰正极材料是构成电池放电容量的重要基础,电池内使用的二氧化锰愈多,电池的放电容量也就愈大。纸板式锌-锰干电池的实际放电容量比普通的糊式锌-锰干电池要高出2~3倍。标有“高性能”字样的干电池绝大部分为纸板式。
碱性锌-锰干电池 其电解质由汞齐化的锌粉、35%的氢氧化钾溶液再加上一些钠羧甲基纤维素经糊化而成。由于氢氧化钾溶液的凝固点较低、内阻小,因此碱性锌-锰干电池能在-20℃温度下工作,并能大电流放电。其一次容量比普通锌-锰干电池高约2~3倍,而在重负荷及连续放电情况下可达10倍以上,若充电使用可达100倍以上。碱性锌-锰干电池可充放电循环40多次,但充电前不能进行深度放电(保留60~70%的容量),并需严格控制充电电流和充电期终的电压。
叠层式锌-锰干电池 由几个结构紧凑的扁平形单体电池叠在一起构成。每一个单体电池均由塑料外壳、锌皮、导电膜以及隔膜纸、炭饼(正极)组成。隔膜纸是一种吸有电解液的表面有淀粉层的浆层纸,它贴在锌皮的上面;隔膜纸上面是炭饼。隔膜纸如同糊式干电池的电糊层,起隔离锌皮负极和炭饼正极的作用。叠层式锌-锰干电池减去了圆筒形糊式干电池串联组合的麻烦,其结构紧凑、体积小、体积比容量大,但贮存寿命短且内阻较大,因而放电电流不宜过大。
畜电池 通过充电将电能转变为化学能贮存起来,使用时再将化学能转变为电能释放出来的一种化学电池。其转变的过程是可逆的。当蓄电池已完全放电或部分放电后,两电极板表面形成新的化合物,这时若用适当的反向电流通入蓄电池,就可以使在放电过程中形成的化合物还原为原先的活性物质,供下次放电再用,此过程叫充电,即将电能以化学能的形式贮存在蓄电池中。电池接通负载供给外电路电流的过程叫放电。蓄电池的充电和放电过程可以重复循环多次,故蓄电池又称为二次电池。
按所使用的电解质溶液的不同,蓄电池分为酸性和碱性两大类。按正负极板所使用的活性物质材料又有铅蓄电池、镉镍、铁镍、银锌、镉银蓄电池等几种。铅蓄电池为酸性电池,后四种为碱性电池。
铅蓄电池 由正极板群、负极板群、电解液和容器等组成。充电后的正极板是棕褐色的二氧化铅(PbO2),负极板是灰色的绒状铅(Pb),当两极板放置在浓度为27~37%的硫酸(H2SO4)水溶液中时,极板的铅和硫酸发生化学反应,二价的铅正离子(Pb2+)转移到电解液中,在负极板上留下两个电子(2e-)。由于正负电荷的引力,铅正离子聚集在负极板的周围,而正极板在电解液中水分子作用下有少量的二氧化铅(PbO2)渗入电解液,其中两价的氧离子和水化合,使二氧化铅分子变成可离解的一种不稳定的物质──氢氧化铅 [Pb(OH)4]。氢氧化铅由4价的铅正离子(Pb4+)和4个氢氧根[4(OH)-]组成。4价的铅正离子(Pb4+)留在正极板上,使正极板带正电。由于负极板带负电,因而两极板间就产生了一定的电位差,这就是电池的电动势。当接通外电路,电流即由正极流向负极。在放电过程中,负极板上的电子不断经外电路流向正极板,这时在电解液内部因硫酸分子电离成氢正离子(H+)和硫酸根负离子(SO厈),在离子电场力作用下,两种离子分别向正负极移动,硫酸根负离子到达负极板后与铅正离子结合成硫酸铅(PbSO4)。在正极板上,由于电子自外电路流入,而与4价的铅正离子化合成2价的铅正离子,并立即与正极板附近的硫酸根负离子结合成硫酸铅附着在正极上。铅蓄电池正、负极板在放电过程中的化学反应为

随着蓄电池的放电,正负极板都受到硫化,同时电解液中的硫酸逐渐减少,而水分增多,从而导致电解液的比重下降。在实际使用中,可以通过测定电解液的比重来确定蓄电池的放电程度。在正常使用情况下,铅蓄电池不宜放电过度,否则将使和活性物质混在一起的细小硫酸铅晶体结成较大的晶体,这不仅增加了极板的电阻,而且在充电时很难使它再还原,这直接影响蓄电池的容量和寿命。
铅蓄电池充电是放电的逆过程。在充电电源的作用下,负极板上的硫酸铅首先游离为 2价的铅离子和硫酸根负离子,然后2价的铅离子在负极板上获得电子,被中和为铅;同时负极板上的硫酸根离子和电解液中的氢离子结合而还原为硫酸。正极板在充电电源的作用下,硫酸铅也被离解为2价的铅离子和硫酸根负离子。由于2价的铅离子向外电路放出两个电子而成为4价铅离子,4价铅离子与电解液中的 4个水分子分离出来的四个氢氧根离子化合成不稳定的氢氧化铅,氢氧化铅游离后恢复为多孔性的二氧化铅,同时生成水,而正极板上的硫酸根离子和电解液中的氢氧根离子还原为硫酸。充电时总的化学反应为

铅蓄电池的工作电压平稳、使用温度及使用电流范围宽、能充放电数百个循环、贮存性能好(尤其适于干式荷电贮存)、造价较低,因而应用广泛。采用新型铅合金,可改进铅蓄电池的性能。如用铅钙合金作板栅,能保证铅蓄电池最小的浮充电流、减少添水量和延长其使用寿命;采用铅锂合金铸造正板栅,则可减少自放电和满足密封的需要。此外,开口式铅蓄电池要逐步改为密封式,并发展防酸、防爆式和消氢式铅蓄电池。
碱性蓄电池 与同容量的铅蓄电池相比,其体积小,寿命长,能大电流放电,但成本较高。碱性蓄电池按极板活性材料分为铁镍、镉镍、锌银蓄电池等系列。以镉镍蓄电池为例,碱性蓄电池的工作原理是:蓄电池极板的活性物质在充电后,正极板为氢氧化镍(Ni(OH)3),负极板为金属镉(Cd);而放电终止时,正极板转变为氢氧化亚镍(Ni(OH)2),负极板转变为氢氧化镉(Cd(OH)2),电解液多选用氢氧化钾 (KOH)溶液。在充放电过程中总的化学反应式为
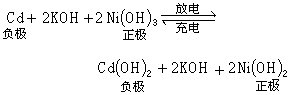 由充放电过程中的化学反应可知,电解液仅作为电流的载体而浓度并不发生变化,因而只能根据电压的变化来判断充放电的程度。
由充放电过程中的化学反应可知,电解液仅作为电流的载体而浓度并不发生变化,因而只能根据电压的变化来判断充放电的程度。镉镍密封蓄电池在充电过程中,正极析出氧气,负极析出氢气。由于镉镍密封蓄电池在制造时负极物质是过量的,这就避免了氢气的发生;而在正极上产生的氧气,由于电化学作用被负极吸收,因此防止了气体在蓄电池内部集聚,从而保证了蓄电池在密封条件下正常工作。
镉镍蓄电池已有了几十年的历史,最初用作牵引、起动、照明及信号电源,现代用作内燃机车、飞机的起动及点火电源。60年代制成的密封式电池则用作人造卫星、携带式电动工具、应急装备的电源。镉镍蓄电池改进的方向之一是采用双极性结构,这种结构的内阻很小,适用于脉冲大电流放电,能满足大功率设备的供电需要;此外,电极采用压成式、烧结式和箔式。
金属-空气电池 以空气中的氧气作为正极活性物质,金属作为负极活性物质的一种高能电池。使用的金属一般是镁、铝、锌、镉、铁等;电解质为水溶液。其中锌-空气电池已成为成熟的产品。
金属-空气电池具有较高的比能量,这是因为空气不计算在电池的重量之内。锌-空气电池的比能量是目前生产的电池中最高的,已达400wh/kg,是一种高性能中功率电池,并正向高功率电池的方向发展。目前生产的金属-空气电池主要是一次电池;研制中的二次金属-空气电池为采用更换金属电极的机械再充电电池。由于金属-空气电池工作时要不断地供应空气,因此它不能在密封状态或缺少空气的环境中工作。此外,电池中的电解质溶液易受空气湿度的影响而使电池性能下降;空气中的氧会透过空气电极并扩散到金属电极上,形成腐蚀电池引起自放电。
燃料电池 只要连续供应化学原料就能发生化学反应,而将化学能转变为电能的电解质电池。这些化学原料在电池内部(一种原料在正极而另一种在负极)发生反应时,必须防止它们直接反应,否则将产生化学短路,不能从反应中获得电能。适用于燃料电池的化学反应很多,目前应用的主要是燃烧反应。由于进行燃烧反应所需的氧在空气中的含量几乎是无限的;而所用的燃料理论上可以是任何一种可燃气体,例如氢气、碳氢化合物气体等。但由于很难找到合适的可用作电极材料的催化剂,故进入实用阶段的只有氢氧燃料电池。由于氢氧燃料电池要使用贵重金属铂作电极材料,成本过高,因此这种电池现在仅用作宇宙飞船的电源。燃料电池的转换效率高、比能高、工作时无噪声无污染、结构简单。
其他能量转换电池 主要有太阳电池、温差电池和核电池。
太阳电池是将太阳光的能量转换为光能的装置,由半导体制成。当太阳光照射电池表面时,半导体PN结的两侧形成电位差。其效率在百分之十以上。 将两种金属接成闭合回路,并在两接头处保持不同温度时,回路中就会产生温差电动势,这种装置称作温差电偶。将温差电偶串联成温差电堆时,即构成温差电池。也可用半导体材料制成温差电池,其温差效应较强。
将核能直接转换成电能的装置称做核电池。通常由辐射β射线(高速电子流)的放射性源、收集这些电子的集电器以及绝缘体三部分组成。放射性源一端因失去负电而成为正极,集电器一端得到负电成为负极,两电极间形成电位差。这种核电池电压高,但电流小。