酸碱平衡(卷名:现代医学)
acid-base balance
体液中酸碱度稳定的现象。溶液中能产生H+的溶质称为酸;能与H+结合的溶质称为碱。例如在
 这一反应式中,H2CO3为酸,HCO婣为碱。体液中的氢离子浓度,即[H+],通常用pH来表示,[H+]的-log值即为pH。溶液pH<7时为酸性;>7时为碱性;=7时为中性。
这一反应式中,H2CO3为酸,HCO婣为碱。体液中的氢离子浓度,即[H+],通常用pH来表示,[H+]的-log值即为pH。溶液pH<7时为酸性;>7时为碱性;=7时为中性。食物在人体被消化、吸收后经肝脏代谢,可产生大量酸性代谢产物。正常成人每日每千克体重约可产生H+1mmol ,儿童2~3mmol,以70千克体重成人为例,每日约可产H+70mmol,即等于7×107nmol(nM),可使细胞外液(占体重约20%)的[ H+]增加达5×106nmol/L,严重影响体液的pH。但实际上在正常生理情况下,机体能使体液的pH维持在7.35~7.45这一狭窄范围内,即体液[H+]=40±5nmol/L、仅为上述每日产生[H+]的12.5万分之一。99%以上的H+均通体液中的缓冲物质及肺、肾的调节被中和并被清除。这种使体液pH稳定地保持在正常范围的现象,即称酸碱平衡。
体液的正常pH,对人体维持多种生理功能十分重要。例如体内各种生物化学反应所需的酶,都必须在一定pH条件下才能有活性;氧在体内的转运,血液凝固及肌肉(包括心肌)的收缩……也都要求在此酸碱度范围内才能正常地进行。而机体是在每日产生及消除大量H+的基础上来维持体液低水平[H+]的,因此这种平衡极易被破坏。例如呼吸或肾功能发生障碍,胃肠道由于呕吐丢失大量H+,腹泻丢失大量HCO婣;代谢异常产生大量有机酸(如乳酸、酮体)时,均可出现酸碱平衡失调,即酸中毒或碱中毒。酸碱失衡将严重影响全身各脏器的功能,属全局性的紊乱,当pH<6.8或>7.8±1时,人体常不能存活。
酸碱平衡的调节 酸碱平衡主要依靠以下三方面的调节:
体液缓冲系统 缓冲系统由弱酸与其盐类组成(这称为缓冲对),具有迅速中和酸及碱的双重作用,可使体液pH不发生显著升降。人体缓冲系可归为三类:
①
 ;②蛋白质-/H蛋白质(包括血红蛋白钾盐/血红蛋白);③
;②蛋白质-/H蛋白质(包括血红蛋白钾盐/血红蛋白);③ 。其中以
。其中以 系统最重要,因其缓冲容量较大,且有肺、肾作后盾。血浆、细胞间液、细胞内液及骨质均有各自的缓冲系(见表)。它们各自分担、互相协同处理酸或碱,最终使各部分体液的pH达到平衡,但这过程需经一定时间。血浆区加入HCl后,30分钟左右血浆pH才能与细胞间液达平衡;数小时后才能与细胞内液达平衡;骨内平衡需2~3天,故只在慢性持续性酸碱失衡时才起缓冲作用。虽然细胞间液及细胞内液的缓冲作用较缓慢,但缓冲容量大,细胞间液缓冲容量为血浆的3倍;细胞内液缓冲容量占总体液缓冲容量的50%。
系统最重要,因其缓冲容量较大,且有肺、肾作后盾。血浆、细胞间液、细胞内液及骨质均有各自的缓冲系(见表)。它们各自分担、互相协同处理酸或碱,最终使各部分体液的pH达到平衡,但这过程需经一定时间。血浆区加入HCl后,30分钟左右血浆pH才能与细胞间液达平衡;数小时后才能与细胞内液达平衡;骨内平衡需2~3天,故只在慢性持续性酸碱失衡时才起缓冲作用。虽然细胞间液及细胞内液的缓冲作用较缓慢,但缓冲容量大,细胞间液缓冲容量为血浆的3倍;细胞内液缓冲容量占总体液缓冲容量的50%。
体液的pH与缓冲系统的关系可用亨德森-哈塞尔巴尔赫二氏公式来表示 :
 以碳酸氢盐系统为例
以碳酸氢盐系统为例 可简化为
可简化为 当
当 时,
时,pH=7.4
以碳酸氢盐缓冲为例说明缓冲机理,当内源或外源的固定酸(碳酸以外的酸)进入体液时,缓冲系HCO婣与之发生反应:
 其效应是:①强酸变弱酸,避免pH急剧下降;②消耗了碱储备(HCO婣有缓冲酸的作用,故称为碱储备),故二氧化碳结合力下降;③H2CO3增多;④酸根,如SO厈,HPO厈或有机酸根在体内堆积。缓冲系统虽可防止pH急剧下降,但上述四方面影响的消除,尚需肺及肾的调节。同样,当碱性液进入体液后,H2CO3与之反应:
其效应是:①强酸变弱酸,避免pH急剧下降;②消耗了碱储备(HCO婣有缓冲酸的作用,故称为碱储备),故二氧化碳结合力下降;③H2CO3增多;④酸根,如SO厈,HPO厈或有机酸根在体内堆积。缓冲系统虽可防止pH急剧下降,但上述四方面影响的消除,尚需肺及肾的调节。同样,当碱性液进入体液后,H2CO3与之反应: 缓冲系统可使强碱变为弱碱,避免pH急剧上升,H2CO3降低,碱储备增加,最终需肺与肾予以恢复。
缓冲系统可使强碱变为弱碱,避免pH急剧上升,H2CO3降低,碱储备增加,最终需肺与肾予以恢复。肺的调节 糖和脂肪等在体内氧化后最终虽可产生大量H2CO3,H2CO3又可发生这样的变化:
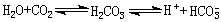 但由于呼吸时不断排出 CO2,使上述反应式由右向左进行,使体内的[H+]不产生多大影响。
但由于呼吸时不断排出 CO2,使上述反应式由右向左进行,使体内的[H+]不产生多大影响。上述固定酸被碱储备缓冲,pH下降,可刺激呼吸中枢使呼吸加深加快,排出更多CO2,使H2CO3下降(缓冲系统的效应③被消除)、[HCO婣]/[H2CO3]接近正常的20/1 ,pH趋向于正常(①被部分消除)。同理,当代谢性碱中毒时,呼吸受抑,使血中H2CO3升高,以使体液pH接近正常。呼吸代偿一般需经 8~12小时才能达最大限度。
肾的调节 肾小管细胞可通过排出H+,产生新的
 ,以补充被消耗的HCO婣(缓冲系统效应②被消除)。H+与由肾小球滤过的酸根结合后,由尿排除(效应④被消除)。肾调节可使pH恢复正常(效应①完全消除),但肾调节较慢,一般需几天才完成。其具体调节方式如下:
,以补充被消耗的HCO婣(缓冲系统效应②被消除)。H+与由肾小球滤过的酸根结合后,由尿排除(效应④被消除)。肾调节可使pH恢复正常(效应①完全消除),但肾调节较慢,一般需几天才完成。其具体调节方式如下:①HCL婣重吸收。由肾小球滤过的HCO婣,几乎全部再由肾小管吸收,回吸80~90%位于近端肾小管。这一过程并未增加体液碱储备,也不影响其pH。碱中毒时,血浆HCO婣增加,尿中NaHCO3排出增加,使体液 pH下降(图1)。

②H+的排泌。主要通过远端肾小管,其方式有二:一为被肾小球过滤的Na2HPO4与肾小管排泌的H+结合,以弱酸NaH2PO4的形式由尿排出(图2)。二为肾小管细胞分解谷氨酰胺而产生NH3,NH3可扩散至肾小管腔与肾排泌的H+结合,形成NH嬃,NH嬃与被肾小球过滤的酸根结合,形成铵盐由尿排出(图3)。

