镭(卷名:化学)
radium
一种天然放射性元素,化学符号Ra,原子序数88,原子量226.0254,属周期系ⅡA族,为银白色金属。镭的放射性很强,其英文名来源于拉丁文radius,原意为“射线”。
发现 1898年M.居里和P.居里等从沥青铀矿矿渣中发现了镭,1902年分离出90毫克氯化镭,初步测定了镭的原子量。
存在 已发现质量数206~230的全部镭同位素,除镭223、镭224、镭226和镭228是天然放射性同位素外,其余都是通过人工核反应合成的。镭226半衰期最长,天然丰度最大,是镭的最重要的同位素。它是铀镭放射性衰变系的成员,存在于所有铀矿石中,在达到放射性平衡的矿石中,镭与铀的重量比为3.4×10-7:1。
镭在自然界分布很广,但含量极微。地壳中镭的平均丰度为1×10-9%,总量为1.8×107吨。海水中镭的浓度约10-13克/升,全世界海洋中约有2万吨镭。
性质 镭同位素的主要核性质见表。镭226主要按下述衰变链衰变:
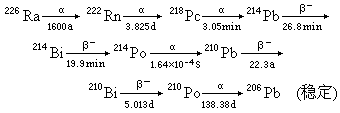 放射性随时间逐渐增强,第30天达到极大值,α放射性为原来的4倍。达到放射性平衡后,1克镭的放射性活度为3.7×1010贝可。镭或其化合物吸收衰变过程中发射α粒子和β-粒子,在密封状态及短期平衡下1克镭平均每小时能产生130卡的热。
放射性随时间逐渐增强,第30天达到极大值,α放射性为原来的4倍。达到放射性平衡后,1克镭的放射性活度为3.7×1010贝可。镭或其化合物吸收衰变过程中发射α粒子和β-粒子,在密封状态及短期平衡下1克镭平均每小时能产生130卡的热。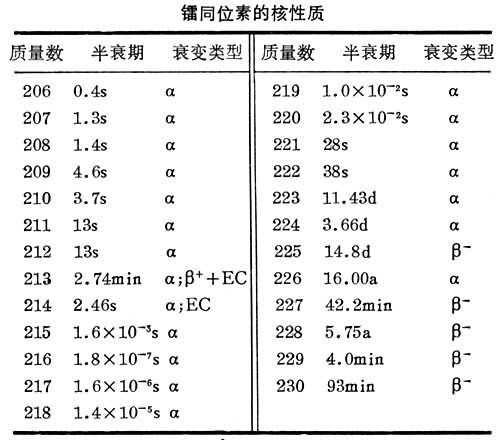
镭有银白色金属光泽,熔点700℃,沸点低于1140℃,密度约5克/厘米3,体心立方晶格。镭原子的电子构型为(Rn)7s2,氧化态为+2,化学性质活泼。金属镭暴露在空气中迅速反应,生成氧化物和氮化物;与水反应生成氢氧化镭。新制备的镭盐呈白色,放置后因受辐照而变色。在镭的水溶液中,水分子辐解,每克镭每天放出13厘米3气体。
所有镭盐都与相应的钡盐同晶。硫酸镭、碳酸镭、铬酸镭和碘酸镭微溶于水;而氯化镭、溴化镭、硝酸镭和氢氧化镭易溶于水。除碳酸镭外,镭盐在水中的溶解度均较相应的钡盐小。钡与镭的性质十分相似,因此常用钡作微量镭的载体。
制取 镭是铀工业的副产物。用硫酸从铀矿石浸出铀时,镭以硫酸盐形式存在于矿渣中。用热的碳酸钠溶液将硫酸镭转化为碳酸镭,然后用稀盐酸溶解,经分级结晶或离子交换色谱法分离,得到纯度较高的镭盐。中国研究出用硝酸将铀和镭一起浸出的提镭流程,在浸出液中加入铅载体和硫酸,使硫酸铅(钡、镭)沉淀;沉淀用乙二胺四乙酸碱性溶液溶解,选择沉淀除铅,通过阳离子交换树脂柱进行分离,得到纯度95%以上的镭盐。金属镭由氯化镭溶液电解还原制得。
应用 在现代核工业兴起以前,镭是最重要的放射性物质,广泛应用于医疗、工业和科研等领域。镭和它的衰变产物发出的γ射线,能破坏恶性组织,故可用镭针或镭管来治疗癌症。把镭盐和硫化锌荧光粉混匀,可制成永久性发光粉;各种仪表和钟表涂了发光粉后,可在暗处发光,便于人们观测。工业上用镭作γ射线照相,对金属材料或其他固体的内部裂缝和缺陷进行无损检验。50年代以后,镭在这些方面的应用,已在很大程度上被某些人工放射性核素取代。但镭仍然是重要的放射性标准物质,如在科研和生产中,广泛使用的镭γ标准源和镭-铍中子标准源。此外,镭226还是由(n,γ)核反应制取锕227的原料。到1975年为止,全世界总共生产了约4千克镭,其中85%用于医疗,10%用来制造发光粉。
毒性 镭是剧毒物质,它能取代钙而在骨骼内浓集。急性中毒时,会造成骨髓的损伤以及造血组织的严重破坏等;慢性中毒时,可引起骨瘤和白血病。镭 226在人体内的最大容许积存量为3.7×103贝可,在放射性工作场所空气中的最大容许浓度为1.1×10-3贝可/升,在露天水源中的限制浓度为1.1贝可/升。
参考书目
K. M. Bagnall,Chemistry of the Rare Radioele-ments: Polonium-Actinium,Academic Press , New York,1957.