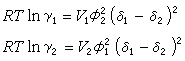规则溶液理论(卷名:化学)
regular solution theory
又称溶解度参数理论。规则溶液是指当极少量的一个组分,从理想溶液迁移到具有相同组成的溶液时,总体积保持不变,熵没有发生变化的一类溶液。规则溶液理论于20世纪20年代后期由J.H.希尔德布兰德建立。其成就在于以纯组分的摩尔体积和溶解度参数来计算溶液的过量吉布斯函数以及活度系数,所导出的过量吉布斯函数恒大于零,不适用于对理想溶液负偏差的溶液,比较成功地解释了碘的溶解度以及某些溶质在相当广泛的非极性溶剂中的溶解度。
该理论的要点为:假定两种液体分子的大小没有显著差别,没有由于偶极或氢键等因素所引起的溶液中分子的特殊取向,分子在溶液中作完全无规则的混合,在等容条件下,摩尔数为n1和n2的两种液体混合,具有与理想溶液相同的混合熵:
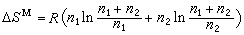 (1)式中 R为气体常数。混合能由混合物位能与两种纯液体的位能来确定。设液体的摩尔位能与全部分子成对的相互作用能 ε(r)有关,晶体的晶格能是由ε(r)对全部影响所及的晶格求和而得,液体的位能则由一连续的径向分布函数g(r)积分而得。径向分布函数是以已知分子为中心,在距离r处发现的另一分子的几率。对于摩尔数为n的纯液体,其蒸发能为:
(1)式中 R为气体常数。混合能由混合物位能与两种纯液体的位能来确定。设液体的摩尔位能与全部分子成对的相互作用能 ε(r)有关,晶体的晶格能是由ε(r)对全部影响所及的晶格求和而得,液体的位能则由一连续的径向分布函数g(r)积分而得。径向分布函数是以已知分子为中心,在距离r处发现的另一分子的几率。对于摩尔数为n的纯液体,其蒸发能为: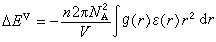 式中NA为阿伏伽德罗数;V为液体的摩尔体积。对于摩尔数为n1和n2的二元混合液体,其蒸发能为:
式中NA为阿伏伽德罗数;V为液体的摩尔体积。对于摩尔数为n1和n2的二元混合液体,其蒸发能为: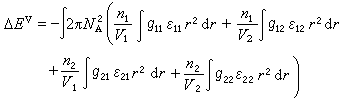 这里在理论处理上作了些近似和简化,包括假定两个不同种分子的作用能等于两个同种分子的作用能的几何平均值:
这里在理论处理上作了些近似和简化,包括假定两个不同种分子的作用能等于两个同种分子的作用能的几何平均值:ε12=(ε11ε22)┩可导出两种非极性液体的混合能ΔEM:
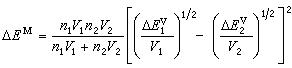 (2)
(2)根据定义,混合过程中体积不变,从式(1)和(2)可推导出过量吉布斯函数GE:
GE=(x1V1+x2V2)(δ1-δ2)2φ1φ2式中x1和x2为组分的摩尔分数;δ1和δ2为组分的溶解度参数;φ1和φ2为组分的体积分数:
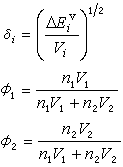 活度系数γ1和γ2见下式:
活度系数γ1和γ2见下式: