铊(卷名:矿冶)
thallium
元素符号Tl,柔软的银白色金属,在元素周期表中属ⅢA族,原子序数81,原子量204.37,六方晶体,常见化合价为+1、+3。
1861年英国人克鲁克斯(W. Crookes)在研究硫酸厂残渣时,由光谱发现一种具有特殊绿色谱线的元素;第二年制出少量金属,根据拉丁文thallus(绿色的嫩枝)命名。
已知的铊矿物均无工业价值
 铊主要是从有色重金属硫化矿冶炼过程中作为副产品回收的
铊主要是从有色重金属硫化矿冶炼过程中作为副产品回收的 铊的氧化物
铊的氧化物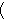 Tl2O3
Tl2O3 特别是一氧化铊(Tl2O)和氯化铊挥发性强。它们在铜、铅、锌硫化物精矿焙烧、烧结和冶炼时大部分挥发进入烟尘。如炼铅时约有60~70%的铊进入烧结、焙烧烟尘中。铅鼓风炉烟尘的铊含量约占精矿中铊含量的23%。硫酸厂焙烧黄铁矿时,炉气净化系统的富铊烟尘也可作提取铊的原料。铊盐有毒。在有色重金属冶炼流程中回收铊,既有利于有色重金属资源的综合利用,又能防止污染环境。
特别是一氧化铊(Tl2O)和氯化铊挥发性强。它们在铜、铅、锌硫化物精矿焙烧、烧结和冶炼时大部分挥发进入烟尘。如炼铅时约有60~70%的铊进入烧结、焙烧烟尘中。铅鼓风炉烟尘的铊含量约占精矿中铊含量的23%。硫酸厂焙烧黄铁矿时,炉气净化系统的富铊烟尘也可作提取铊的原料。铊盐有毒。在有色重金属冶炼流程中回收铊,既有利于有色重金属资源的综合利用,又能防止污染环境。性质和用途 在电子工业中,用铊激活碘化钠晶体可制作光电倍增管。铊及其化合物可用作光学玻璃、电子元件的玻璃密封以及放射线的屏蔽窗等。硫化铊和硫氧化铊可以制造对红外线很灵敏的光电管。溴化铊或碘化铊的固溶体单晶能透过红外线,可用于红外线通信。含铊8.5%的汞铊合金,其熔点为-60℃,比汞的熔点低20℃,可用于低温仪表。全世界每年铊的消费量不过数千公斤。1977~1978年工业金属铊的价格约为 17.63美元/公斤,高纯金属铊为4美元/金衡盎司
 1金衡盎司为31.1035克
1金衡盎司为31.1035克 。
。 铊冶金 铊在冶炼原料中含量很低,必须先行富集。火法富集可使物料的含铊量提高10倍以上。烟尘中的铊多半是氧化铊、硫酸铊和氯化铊。用稀硫酸浸出(见浸取)含铊烟尘时,锌、镉、铁及其他元素同时进入溶液。含铊0.05~1克/升的稀溶液可用高锰酸钾将Tl+氧化成Tl3+,根据铊、锌、镉在不同的pH沉淀的原理,以氢氧化钠中和溶液至pH为4~5,并加热至70~80℃,使铊从溶液中以氢氧化铊的形态沉淀析出。如溶液含铊大于5克/升时,可在20℃加过量的氯化钠使铊以难溶的氯化铊形态沉淀下来。
铊冶金 铊在冶炼原料中含量很低,必须先行富集。火法富集可使物料的含铊量提高10倍以上。烟尘中的铊多半是氧化铊、硫酸铊和氯化铊。用稀硫酸浸出(见浸取)含铊烟尘时,锌、镉、铁及其他元素同时进入溶液。含铊0.05~1克/升的稀溶液可用高锰酸钾将Tl+氧化成Tl3+,根据铊、锌、镉在不同的pH沉淀的原理,以氢氧化钠中和溶液至pH为4~5,并加热至70~80℃,使铊从溶液中以氢氧化铊的形态沉淀析出。如溶液含铊大于5克/升时,可在20℃加过量的氯化钠使铊以难溶的氯化铊形态沉淀下来。工业上回收铊的方法还很多,以铅烧结烟尘回收铊为例:铅烧结烟尘经反射炉熔炼富集后,得到含铊2%左右的富铊灰,用浓度为120~150克/升硫酸浸出,固液比为1:5,温度为90℃,搅拌4小时,浸出率在95%以上。浸出液用软锰矿氧化,溶液过滤后,用工业氯化钠、工业硫酸分别调整氯离子浓度为0.5N,酸度为1.5N,作为萃取铊的原料液,再以15%A-101(二烷基乙酰胺)-二乙苯为萃取剂进行溶剂萃取。洗涤后的含铊有机相用1.5N醋酸铵进行反萃取。反萃液经用亚硫酸钠还原,浓硫酸溶解,锌板置换沉淀,即得品位为99.99%的铊。将铊压制成块,并在熔融氢氧化钠保护下铸锭。
高纯铊制备 高纯度铊可采用电解精炼法。用一般方法制得的铊,尚含有铜、铅、镉等杂质,先用碱和硝酸钠与金属铊进行熔炼,使铅生成Na2PbO2除去。如铅含量超过0.03%,则需熔炼2次。此法也可使铜、镉成为氢氧化物除去。电解精炼时,阴极用纯铊或钽片,电解质中铊含量为30~40克/升,硫酸浓度为70克/升,温度为55~60℃,阴极电流密度为100安/米2,阳极电流密度为200安/米2,阳极套以布套。经过二次到三次电解精炼,可获得99.999%的高纯铊(见超纯金属)。
铊毒 铊能伤害神经系统。铊中毒往往是由于吸入或皮肤接触铊及其化合物粉尘,或食用受铊污染的食物和饮水所造成的。主要症状是疲乏无力、肢体疼痛、脱发、脱皮,甚至失明。空气中可溶性铊化合物的容许浓度为0.1毫克/米3。
参考书目
C.A.Hampel ed., Rare Metals Handbook, 2nd ed.,Reinhold, New York, 1961.
A.G.Lee,The Chemistry of Thallium, Elsevier,Amsterdam, 1971.