铬(卷名:矿冶)
chromium
元素符号Cr,银白色金属,在元素周期表中属 ⅥB族,原子序数24,原子量51.996,体心立方晶体,常见化合价为+3、+6和+2。
1797年法国化学家沃克兰 (L.N.Vauquelin)在西伯利亚红铅矿(铬铅矿)中发现一种新元素,次年用碳还原,得金属铬。因为铬能够生成美丽多色的化合物,根据希腊字chroma(颜色)命名为chromium。
资源 工业上使用的铬矿石为铬铁矿,属尖 晶 石(MgO·Al2O3)和磁铁矿(FeO·Fe2O3)类,其通用化学式是(Fe,Mg)O·(Cr,Fe,Al2O3)。由于二价元素(Mg2+、Fe2+、Zn2+ ) 和三价元素(Al3+、Fe3+、Cr3+)相互置换,可以出现各种不同成分的矿石。除主成分FeO及Cr2O3外,一般含有不同成分的 MgO、Al2O3 及其他杂质。矿石结构组成对使用有明显影响,如铬尖晶石比铬铁矿(FeO·Cr2O3)难于还原;含蛇纹石的铬矿石,若其中挥发物大于 2%,用它制造的铬质耐火砖在加热到1000℃时,会因释放结晶水而炸裂。
美国1978年耗用铬铁矿917000吨,其用途分配如下:冶金61%,化工21%,耐火材料18%。1981年伦敦市场铬矿石价格:土耳其矿(48%Cr2O3,Cr/Fe=3)130~135美元/吨,南非(阿扎尼亚)铬矿(44%Cr2O3)60~70美元/吨。
性质和用途 铬为不活泼性金属,在常温下对氧和湿气都是稳定的,但和氟反应生成CrF3。温度高于600℃时铬和水、氮、碳、硫反应生成相应的Cr2O3,Cr2N和CrN, Cr7C3和Cr3C2,Cr2S3。铬和氧反应时开始较快,当表面生成氧化薄膜之后速度急剧减慢;加热到1200℃时,氧化薄膜破坏,氧化速度重新加快,到2000℃时铬在氧中燃烧生成Cr2O3。铬很容易和稀盐酸或稀硫酸反应,生成氯化物或硫酸盐,同时放出氢气。
由于铬合金性脆,作为金属材料使用还在研究中,铬主要以铁合金(如铬铁)形式用于生产不锈钢及各种合金钢。金属铬用作铝合金、钴合金、钛合金及高温合金、电阻发热合金等的添加剂。氧化铬用作耐光、耐热的涂料,也可用作磨料,玻璃、陶瓷的着色剂,化学合成的催化剂。铬矾、重铬酸盐用作皮革的鞣料,织物染色的媒染剂、浸渍剂及各种颜料。镀铬和渗铬可使钢铁和铜、铝等金属形成抗腐蚀的表层,并且光亮美观,大量用于家具、汽车、建筑等工业。此外,铬矿石还大量用于制作耐火材料。
1978年世界金属铬生产能力为:电解法6000吨,铝热法4300吨。日本1978年生产金属铬2884吨,1977年的消费分配为:高温合金40%,铝合金31%,焊条25%。1981年伦敦市场纯度大于99%的块状铬的价格为4050~4250镑/吨。

钢铁工业中广泛应用的铬铁合金和硅铬合金是用电炉冶炼的。金属铬生产则采用金属热还原(铝热)法及电解法。
铝热法生产 包括从铬矿制取氧化铬和铝还原氧化铬制得金属铬两道工序,主要工艺流程见图1。
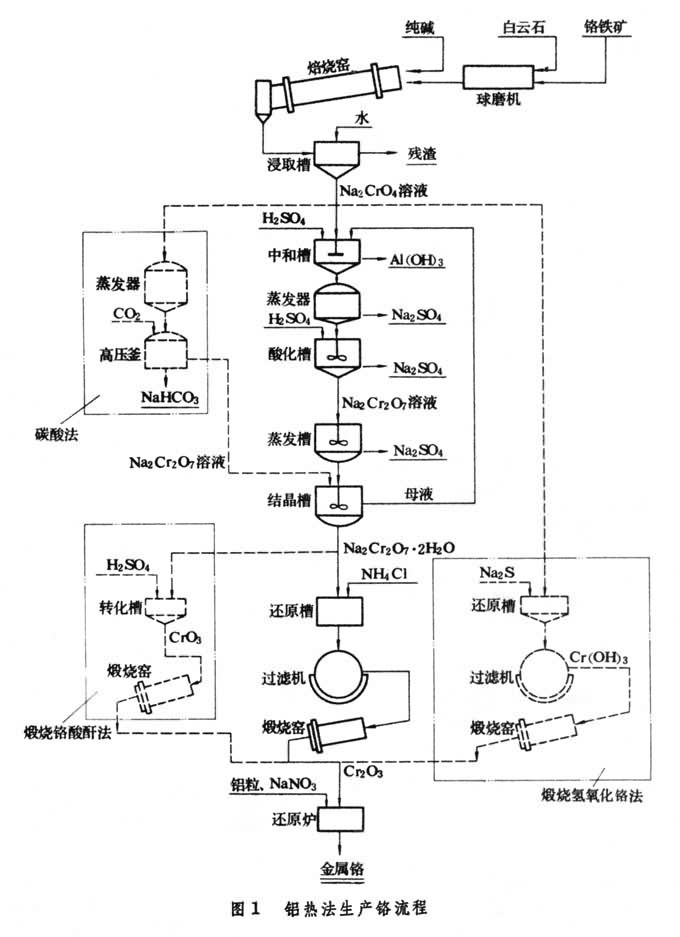
氧化铬制取 铬铁矿磨细至160~200目,配加纯碱和白云石,于1050~1150℃下氧化焙烧,再用水逆流浸出(见浸取)和过滤,获得含Na2CrO4大于 200克/升的溶液。加硫酸中和铬酸钠溶液,使其pH为7~8,滤出氢氧化铝等杂质后蒸发到含Na2CrO4大于 450克/升,滤出Na2SO4结晶。溶液用硫酸调整pH为4±0.2,再滤出Na2SO4结晶,获得重铬酸钠(Na2Cr2O7)溶液。浓缩溶液到约含Na2Cr2O71100克/升时,冷却滤出Na2SO4结晶,再将溶液浓缩到含Na2Cr2O71500~1550克/升,并于90~100℃保温8小时,然后冷却到35℃以下,结晶出重铬酸钠。铬酸钠转化成重铬酸钠也可用碳酸法,即在15~16大气压下通入含50%CO2的气体,析出的沉淀为碳酸氢钠:2Na2CrO4+2CO2+H2O─→Na2Cr2O7+2NaHCO3碳酸氢钠可以回收使用。此法可把在焙烧中配加的纯碱重新回收一半,较硫酸法获得硫酸钠为有利,但铬酸钠不能完全转化为重铬酸钠。
三氧化二铬的制备可用:①氯化铵还原法。即在重铬酸钠晶体中配入一定量的氯化铵,混匀后在还原炉中于700~800℃还原,然后洗去NaCl,过滤获得三氧化二铬滤饼,经过干燥、破碎,在回转窑中于1150~1200℃煅烧。用此法获得的三氧化二铬呈墨绿色,颗粒较大,纯度高,但生产工序多,并产生有害气体 HCl。②煅烧铬酸酐法。即把重铬酸钠加入反应锅中,注入浓硫酸,在200℃下重铬酸钠与硫酸反应生成铬酸酐:
Na2Cr2O7+2H2SO4─→2CrO3+2NaHSO4+H2O静置后铬酸酐和硫酸氢钠沉积成两层。将上部的硫酸氢钠舀出,留在锅中的铬酸酐再加热,用水洗去残留的硫酸钠,从底部放出铬酸酐。铬酸酐在800~950℃下煅烧分解,用水洗去未分解的铬酸酐,过滤获得三氧化二铬。用此法工序少,但产品杂质含量较高。③煅烧氢氧化铬法。即将含Na2CrO4大于 200克/升的溶液加温至95℃以上,加入纯净的硫化钠溶液,搅拌后生成大颗粒氢氧化铬Cr(OH)3沉淀。氢氧化铬在回转窑中于1300℃煅烧分解为三氧化二铬Cr2O3。此法工序少,产品成本低,纯度高,但颗粒细,易损失。
铝热还原 要求原料含 Cr2O3大于99%,含硫低于0.02%,含铅、砷、锡、锑各低于0.001%。铝粒粒度应小于0.5毫米,铝量应不大于理论量的98%。用硝石、镁屑和铝粒作引火剂。反应为:
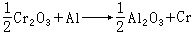
反应焓ΔH圏=-65.0千卡/摩尔(铝)。为了保持自热反应过程并使金属粒与渣顺利分离,ΔH圏至少应为-72千卡/摩尔(铝),要添加硝酸钠、氯酸钾、铬酸酐或碱金属重铬酸盐等供氧剂补充热量;也可将混合料预热到350~400℃再行入炉。还原反应在内砌镁砖的圆锥形炉筒内进行。先在炉内加入部分混合炉料,在料面中心加引火剂,点燃后在炉料开始反应时,用流槽连续送入其余炉料。反应终止,冷却至室温,拆开炉筒取出金属锭,喷砂清除表面夹渣和氧化膜。生产大金属锭,能提高铬的回收率,渣的流动性也好。铝热法可获得纯度大于98.5%的金属铬,其中含铝不大于0.5%。渣中含Al2O3高达90%,可作研磨材料。
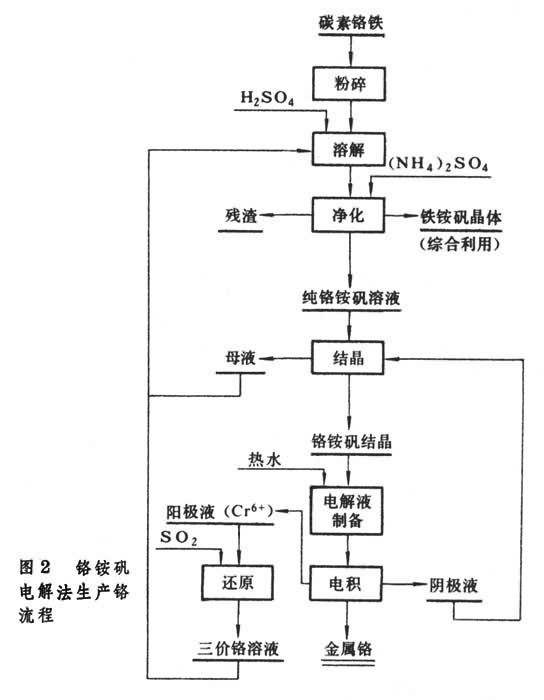
电解法生产 目前一般用碳素铬铁作原料,采用铬铵矾法电解流程(图2)。把碳素铬铁粉碎,溶于电解阳极返回液、结晶母液和硫酸的混合溶液中,过滤除去硅酸盐等残渣,滤液用硫酸铵处理并除铁。纯铬铵矾溶液经陈化(保持30~35℃,放置15日)后,结晶出纯铬铵矾Cr2(SO4)3·(NH4)2SO4·24H2O。纯铬铵矾溶于热水送入隔膜电解槽电解。用不锈钢作阴极,铅银合金(1%Ag)作阳极,电流密度753安/米2,槽电压 4.2伏,电解液温度52~54℃。应控制通过电解液进入阳极室的流速,并准确地控制溶液的pH为2.1~2.4。平均电流效率 45%,电耗约18.5千瓦·时/公斤。产品纯度为99.2~99.4%的片状金属铬,含氧0.3~0.5%,呈脆性。为了提高金属铬的纯度,可通过真空处理或氢还原降低含氧量。用+6价铬溶液电解(电流密度 9500安/米2,温度84~87℃),可得高纯度金属铬(含氧0.01~0.02%),但电流效率很低(6~7%)。
铬害防护 铬酸盐、重铬酸盐等都对人体的粘膜起强烈的腐蚀作用,吸入含有铬化合物的粉尘和蒸气会损坏鼻粘膜,并使鼻中软骨穿孔。受到大量铬的侵害时会出现肾脏病。当铬化合物的作用受到吸烟的助长,特别容易促致肺癌。因此,要求铬的生产设备密闭,有高效能除尘设施,操作场所通风良好。
参考书目
A. H. Sully & E. A. Brandes,Chromium,2nd ed.,Butterworths,London,1967.
M.Y.Udy,Chromium,ACS Monograph,No.132,Reinhold,New York,1960.