二氧化碳(卷名:化学)
carbon dioxide
化学式CO2。无色、无臭、无味、无毒气体;熔点-56.6℃(5.2大气压),密度 1.977 克/升,临界温度31.04℃,临界压力 72.85大气压。 在水中的溶解度为0.1449克/100克水(25℃)。在20℃时,将二氧化碳加压到59大气压即可液化,液态二氧化碳迅速蒸发,由于吸热会使其一部分蒸气骤冷,形成雪花状固体,这种固体气化时不产生液体,俗称“干冰”。
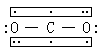
二氧化碳是直线型分子,结构式如左。分子中C─O键长为1.16埃,键能为531.4千焦/摩尔。分子的偶极矩为0,是非极性分子。二氧化碳有很高的热稳定性,只在高温下才分解成一氧化碳和氧。
化学性质 二氧化碳为酸性氧化物,溶于水产生碳酸;与碱作用生成酸式碳酸盐和碳酸盐:
CO2+H2O
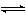 H2CO3
H2CO3CO2+OH-─→HCO婣
CO2+2OH-─→CO娫+H2O二氧化碳在赤热炭的作用下还原成一氧化碳:
CO2+C─→2CO在加热下,二氧化碳可与活泼金属生成碳和碳酸盐或金属氧化物,如:
4K+3CO2─→2K2CO3+C
2Mg+CO2─→2MgO+C二氧化碳在无水或有水条件下能迅速与二甲胺作用,分别生成氨基甲酸酯或碳酸酯:
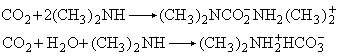 二氧化碳还能与氨作用,生成氨基碳酸铵,它在190大气压下加热到180℃时转变成尿素:
二氧化碳还能与氨作用,生成氨基碳酸铵,它在190大气压下加热到180℃时转变成尿素: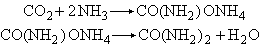 在有水条件下,二氧化碳与氨生成碳酸氢铵:
在有水条件下,二氧化碳与氨生成碳酸氢铵:NH3+CO2+H2O
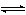 NH4HCO3
NH4HCO3制法 单质碳或含碳的可燃物在充足的氧气中燃烧可产生二氧化碳。有机体的腐烂和人、畜的呼吸也可产生或排出二氧化碳。在工业上,二氧化碳是煅烧石灰石制取石灰或发酵过程的副产品,也是生产氨、汽油和其他化工产品的烃类-蒸气转化炉的副产物。从天然气井和煤的造气炉中也可得到大量的二氧化碳。
在实验室里,常用盐酸和石灰石(或大理石)反应来制取二氧化碳:
CaCO3+2HCl─→CaCl2+H2O+CO2
有时烟道废气也可做二氧化碳的来源,把去除黑烟、炭粒的废气冷却后通入浓的碳酸钾溶液,以吸收二氧化碳,需用时只要将溶液加热即放出二氧化碳。
应用 二氧化碳大量用于生产纯碱、小苏打、氧化铝、铅白、尿素和碳酸氢铵等,还可用作调节溶液酸碱性的试剂、清凉饮料的成分、灭火剂、保鲜剂和制冷剂等。二氧化碳还可用于人工模拟光合作用的研究和农业生产中。
二氧化碳无毒性,在大气中含量为0.03%(体积)左右,某些局部地区或拥挤场所含量会高达1%。在空气中的含量达到3%时,人体会感到呼吸急促,当浓度达到10%时,就会丧失知觉、呼吸停止而死亡。