指示剂(卷名:化学)
indicators
用以指示滴定终点的试剂,它在滴定的等当点(见容量分析)附近产生能察觉到的变化(如颜色变化、生成沉淀等),从而指示滴定终点。在各类滴定过程中,随着滴定剂的加入,被测定物质和滴定剂的浓度都在不断变化,在等当点附近离子浓度会发生较大变化,指示剂可对离子浓度的突变作出显示。(见彩图)



如果滴定剂或被滴定物质是有色的,它们本身就具有指示剂的作用,例如用高锰酸钾作滴定剂时,由于MnO嬄呈紫红色,当滴定到粉红色时,就表示滴定反应完成,指示终点已到达。也可以用与被测物质或滴定剂有特殊反应的试剂作指示剂,例如用乙二胺四乙酸滴定Fe3+时,以磺基水杨酸为指示剂,在到达等当点以前,溶液呈现紫红色(磺基水杨酸与铁的络合物的颜色),当Fe3+定量地与乙二胺四乙酸络合后,紫红色褪去,指示出终点。适用于各类滴定反应的指示剂有以下几种。
酸碱指示剂 指示溶液中H+浓度的变化,是一种有机弱酸或有机弱碱,其酸形与碱形具有不同的颜色。当溶液酸度变化时,酸形与碱形的浓度比发生变化,从而呈现不同的颜色。指示剂酸 HIn在溶液中的平衡及其离解常数可表示为:
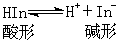
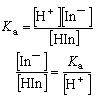 式中[H+]等带括号的式子表示相应物质的浓度。溶液的颜色决定于
式中[H+]等带括号的式子表示相应物质的浓度。溶液的颜色决定于 ,后者又决定于溶液的[H+]。以甲基橙(Ka=10-8.4)为例,其酸形呈红色,碱形呈黄色(见彩图)。在不同的[H+]时,
,后者又决定于溶液的[H+]。以甲基橙(Ka=10-8.4)为例,其酸形呈红色,碱形呈黄色(见彩图)。在不同的[H+]时, 值和溶液的颜色如下表所示:
值和溶液的颜色如下表所示:
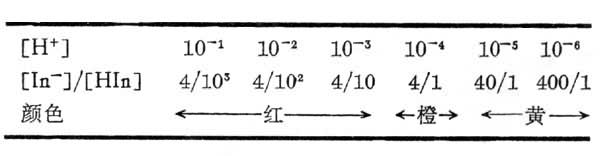
在pH=3.1~4.4时出现的橙色是红色和黄色的混合色,这种目光所能感受出变化的pH范围称为指示剂的变色范围。不同指示剂的Ka不同,其变色范围也不同,下表为最常用的酸碱指示剂的变色范围:

一般指示剂的变色范围都小于2个pH单位,即要使溶液从一种颜色完全转变为另一种颜色,溶液的[H+]要有几十倍的变化,[H+]变化愈大,变色愈明显。
如果等当点附近的[H+]变化不够大,可用混合指示剂(两种指示剂的混合物),其变色范围较窄。例如甲酚红与百里酚蓝以适当比例混合,变色范围为8.2~8.4(粉红~紫)。用盐酸滴定碳酸钠到碳酸氢钠时,等当点的pH是8.3,等当点附近[H+]变化缓慢。使用这一混合指示剂比用单一指示剂能更准确地确定终点。
金属指示剂 是络合滴定法所用的指示剂,它能指示溶液中金属离子浓度的变化,大多是染料,在一定pH下能与金属离子络合,呈现一种与游离指示剂完全不同的颜色,从而指示滴定终点。常用的有二甲酚橙、铬黑T。
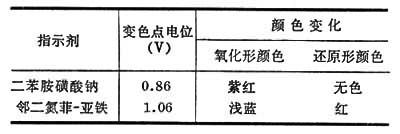
氧化还原指示剂 为氧化剂或还原剂,它的氧化形与还原形有不同的颜色,在氧化还原滴定中,它被氧化(或被还原)而变色,指示出溶液电位的变化,下表列出的是最常用的氧化还原指示剂:
沉淀滴定指示剂 沉淀滴定法主要是 Ag+与卤素离子的滴定,用铬酸钾、铁铵矾或荧光黄作指示剂。