微量量热学(卷名:化学)
microcalorimetry
热化学和量热学的分支学科,研究微量量热法的理论基础、实验技术、热谱解析和应用。一切物理、化学和生物的变化过程均伴随着热量的发生。这些过程的伴生热量往往是很微小的。以化学反应为例,如果反应速率很低,则单位时间内反应过程的放热量也很小,所以这些过程都是微量量热学的研究对象。
微量量热计 是测定微小热量的实验装置。根据非平衡热力学的基本原理,在等环境量热学中,任一变化过程的放热速率Ω 都可以表示为量热体系的温升墹和温升速率夾 的函数:
 式中K和Λ是量热体系的仪器常数。在t时间内变化过程的放热量为:
式中K和Λ是量热体系的仪器常数。在t时间内变化过程的放热量为: 而全过程的总热量为:
而全过程的总热量为: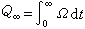 在变化过程中,量热体系的温升对时间的记录曲线称为热谱。根据上述理论,不仅可以从热谱曲线测定变化过程的伴生热量,而且能够测定放热速率。
在变化过程中,量热体系的温升对时间的记录曲线称为热谱。根据上述理论,不仅可以从热谱曲线测定变化过程的伴生热量,而且能够测定放热速率。E.卡尔维特研制的热导式量热计的内部结构如图所示,
 它是一种微量量热计。图中,B为恒温铝块,R和S是结构完全相同的两个孪生式量热元件,S为量热工作池,R为量热参考池。两个量热元件的热电堆对抗相联,这种结构基本上消除了由于环境的温度起伏而产生的干扰。从L1和L2两端输出的温差信号墹,能够准确地显示出量热池内部的微小温升,灵敏度可达十万分之一开。这样的量热计能够检测出变化过程中微瓦级的放热速率,是微量量热学的一个重要成就。
它是一种微量量热计。图中,B为恒温铝块,R和S是结构完全相同的两个孪生式量热元件,S为量热工作池,R为量热参考池。两个量热元件的热电堆对抗相联,这种结构基本上消除了由于环境的温度起伏而产生的干扰。从L1和L2两端输出的温差信号墹,能够准确地显示出量热池内部的微小温升,灵敏度可达十万分之一开。这样的量热计能够检测出变化过程中微瓦级的放热速率,是微量量热学的一个重要成就。今后的发展,除了考虑增加热电偶的数目,进一步提高量热计的灵敏度以外,还应着重考虑用计算机进行热谱数据的自动采集和处理,提高自动化程度。
微量量热法的应用 用微量量热计测定的热谱曲线准确地记录了变化过程中的许多重要信息。根据微量量热学的基础理论,研究热谱曲线的解析方法也是微量量热学的重要内容。20世纪60年代以来,化学反应的摩尔焓和其他热力学函数,以及动力学参数都有可能从热谱曲线上解析出来,故此法的应用范围日益广泛。
热静力学研究 用微量量热法研究可逆反应的热效应,并用来计算其平衡常数。研究中不必考虑化学反应的放热速率。以简单的可逆反应为例:
 可以根据平衡热力学的基本原理证明:在一定的起始条件下,变化过程的总热量Q∞决定于反应的平衡常数K和摩尔焓ΔHm:
可以根据平衡热力学的基本原理证明:在一定的起始条件下,变化过程的总热量Q∞决定于反应的平衡常数K和摩尔焓ΔHm: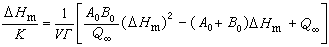 式中A0和B0为反应物的起始浓度;V为反应体系的体积;Γ为体系中有关物质的活度系数的乘积。
式中A0和B0为反应物的起始浓度;V为反应体系的体积;Γ为体系中有关物质的活度系数的乘积。由此可见,在不同的起始条件下,用微量量热计测定出反应过程的热效应后,原则上就可以计算反应体系的平衡常数和反应的摩尔焓。在计算过程中,必须校正一切局外反应的热效应,还要考虑各有关物质的活度系数,因此计算工作量很大。但是热静力学研究可以根据反应热直接计算平衡常数,不必测定物质的低温热容和绝对熵。这是一种新的研究方法,在理论上很有价值。
热动力学研究 用微量量热计测定化学反应的放热速率,并用来计算反应的速率常数。根据非平衡热力学的基本原理可以证明:
 即在反应过程中,化学反应的放热量Q与反应进度x成正比,放热速率Ω 与反应速率凧成正比。因此,原则上化学反应在任何时刻的反应进度和反应速率都可以从热谱曲线求得,再结合化学反应速率定律,例如:
即在反应过程中,化学反应的放热量Q与反应进度x成正比,放热速率Ω 与反应速率凧成正比。因此,原则上化学反应在任何时刻的反应进度和反应速率都可以从热谱曲线求得,再结合化学反应速率定律,例如: 即可算出化学反应的速率常数kn及其他动力学参数,式中n为反应级数。
即可算出化学反应的速率常数kn及其他动力学参数,式中n为反应级数。