焓(卷名:化学)
enthalpy
一种热力学函数,对任何系统来说,焓的定义为:
H=U+pV (1)式中U为系统的内能;p为系统的压力;V为系统的体积。
焓这个名称是荷兰物理学家H.开默林-昂内斯提出的,它来自希腊文,含义是“加热”。因为特定的过程中, 焓的变量 ΔH与热量有关系。焓曾有许多别的名称,如热焓、热容量、热函数和吉布斯热函数等。这些名称都不很确切,中国国家标准GB3102·8-82推荐这个量的名称为焓,符号为H。
式(1)中U、p、V都是系统的状态参量,因此U+pV即焓,也是状态函数,而且是一个广延量。当系统进行某一过程时,焓的变量ΔH只与始态、终态有关,而与中间过程无关。
焓变与热效应的关系 在特定过程中,焓变与热效应有关。如果在恒压和只做体积功的条件下进行某一过程,根据式(1)得到:
ΔH=ΔU=pΔV (2)根据热力学第一定律,当只作体积功时,其表达式为:
ΔU=Qp-peΔV (3)式中pe表示外压。将式(3)代入式(2),得到:
ΔH=Qp (4)式中Qp为恒压过程的热效应,是由状态决定的,而且等于ΔH。从上式看出只有在恒压过程和只做体积功的条件下,系统的焓变ΔH才等于恒压过程热效应。化学上很多过程符合上面两个条件,如恒压相转变(熔融、升华、沸腾)和恒压的化学变化等。因此,可用公式(4)通过焓变ΔH研究恒压过程热效应。
定压热容 定义为:
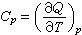 (5)式中Cp为定压热容;T为热力学温度;Q为热效应。式(3)按热力学第一定律的微分表达式为:
(5)式中Cp为定压热容;T为热力学温度;Q为热效应。式(3)按热力学第一定律的微分表达式为:dU=δQp-pdV恒压过程为:
δQp=d(U+pV)=dH (6)将式(6)代入式(5)得到:
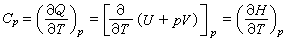 (7)式(7)为定压热容表示式,在恒压和只做体积功的条件下,为系统温度变化所引起系统焓的变化。
(7)式(7)为定压热容表示式,在恒压和只做体积功的条件下,为系统温度变化所引起系统焓的变化。纯物质的标准生成焓 在热力学中内能的绝对值是无法知道的,所以焓的绝对值也不可能得到。人们通常选择某些物质,任意选取某一状态作为标准态,人为地规定出其焓的数值。例如在热工学中的基安-凯斯蒸汽表中,采用在32°F条件下,液体水与其饱和蒸气压平衡时,规定水的焓值为零。在化学热力学中,纯物质焓的标准态采用以下规定(见表)。

标准态没有规定温度的数值,同一种物质随温度的变化,可能有无限多标准态。国际纯粹与应用化学联合会建议选择0K、273.15K、298.15K作为参考温度,优先推荐298.15K。
根据以上的规定,可以得到化合物标准摩尔生成焓(
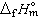 ),例如:
),例如:C(s)+O2(g)─→CO2(g)
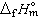 (稳定形态单质石墨,298.15K,101.325kPa )=0
(稳定形态单质石墨,298.15K,101.325kPa )=0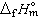 [O2,298.15K,p°(101.325kPa的理想气体)]=0
[O2,298.15K,p°(101.325kPa的理想气体)]=0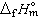 (CO2,298.15K,p →0)=Qp (8)化合物标准摩尔生成焓等于从标准态的稳定单质生成标准态摩尔化合物的恒压过程的热效应Qp。
(CO2,298.15K,p →0)=Qp (8)化合物标准摩尔生成焓等于从标准态的稳定单质生成标准态摩尔化合物的恒压过程的热效应Qp。化学反应的焓变和盖斯定律 对于理想的化学反应,
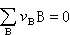 ,在不考虑混合的焓变的情况下,其化学反应摩尔焓变ΔrHm为:
,在不考虑混合的焓变的情况下,其化学反应摩尔焓变ΔrHm为: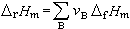 (9)式中vB 为化学反应中的计量系数;B为包含在反应中的分子或原子的符号。式(9)表明,化学反应的焓变等于产物的总生成焓减去反应物的总生成焓。
(9)式中vB 为化学反应中的计量系数;B为包含在反应中的分子或原子的符号。式(9)表明,化学反应的焓变等于产物的总生成焓减去反应物的总生成焓。盖斯定律是热化学中的重要定律,它指出:“如果相同的反应物经过不同的途径得到相同的生成物,则化学反应的恒压热效应是固定的,与途径无关。”因此,可以从容易测定的ΔHm计算出难以测定的ΔrHm;可以从标准摩尔生成焓
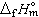 计算化学反应的
计算化学反应的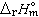 ;可以从燃烧焓计算化学反应的ΔrHm等。
;可以从燃烧焓计算化学反应的ΔrHm等。化学反应的焓变与温度的关系──基尔霍夫定律 设任意的化学反应
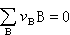 ,从热容的定义可知:
,从热容的定义可知: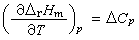 (10)式中ΔCp为产物的总热容减去反应物的总热容。将此式积分,可以从一个温度的化学反应的焓变求得另一个温度的该化学反应的焓变:
(10)式中ΔCp为产物的总热容减去反应物的总热容。将此式积分,可以从一个温度的化学反应的焓变求得另一个温度的该化学反应的焓变: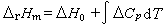 (11)式中 ΔH0为不定积分的积分常数。积分时,必须知道化学反应中各物质的Cp与温度的关系,此关系在个别情况下可从理论导出,但一般都用以下经验公式:
(11)式中 ΔH0为不定积分的积分常数。积分时,必须知道化学反应中各物质的Cp与温度的关系,此关系在个别情况下可从理论导出,但一般都用以下经验公式:Cp,m=a+bT+cT2 (12)或
Cp,m=a+bT+c′/T2 (13)式中a、b、c、c′为经验常数。在应用式(11)时,必须先知道某一温度时化学反应的焓变 ΔrHm,代入到式(11)中,求出ΔH0后,才能计算出另一温度时的化学反应的焓变。通常采用从标准摩尔生成焓
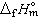 计算出化学反应的
计算出化学反应的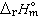 ,作为已知某一温度时的化学反应焓变。
,作为已知某一温度时的化学反应焓变。参考书目
M.L.McGlashan,Chemical Thermodynamics,Academic Press, London, 1979.