电势-pH图(卷名:矿冶)
E-pH diagram
以电势E为纵坐标,pH为横坐标描绘元素-水系中各种反应的平衡条件图。在湿法冶金的浸取过程和金属腐蚀的研究中,经常应用这种图。电势-pH图是在40年代末为比利时普巴(M.Pourbaix)所首创,有关文献常称为普巴(Pourbaix)图。
反应类型 元素-水系中发生的反应可分为两类:
① 有电子得失的还原-氧化反应可表示为:
pOx+nH++ze
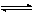 qRed+cH2O (1)式中Ox和Red分别代表物质的氧化态和还原态;p、q、n、c为化学计量系数;z为电子e的迁移数。
qRed+cH2O (1)式中Ox和Red分别代表物质的氧化态和还原态;p、q、n、c为化学计量系数;z为电子e的迁移数。式(1)所示半电池反应的平衡电极电势E,可按涅斯特(Nernst)公式计算,即
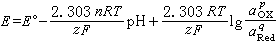 式中E°称为标准电极电势,可由参与反应的各物质的标准化学势计算,其值与温度及压力有关;aOX和aRed分别为物质氧化态和还原态的活度,a
式中E°称为标准电极电势,可由参与反应的各物质的标准化学势计算,其值与温度及压力有关;aOX和aRed分别为物质氧化态和还原态的活度,a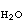 照例取为1;R为气体常数,其数值是8.314焦/(摩·开);F为法拉第常数96490(库仑/摩)。反应(1)的平衡条件描绘在电势-pH图上时,可得到斜率为
照例取为1;R为气体常数,其数值是8.314焦/(摩·开);F为法拉第常数96490(库仑/摩)。反应(1)的平衡条件描绘在电势-pH图上时,可得到斜率为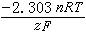 的一条直线,但此直线的位置只有在已知压力、温度以及aOX和aRed的条件下才能够确定。所以,任何电势-pH图的绘制都以指定的压力、温度以及除H+以外的其他物质的活度条件为前提。
的一条直线,但此直线的位置只有在已知压力、温度以及aOX和aRed的条件下才能够确定。所以,任何电势-pH图的绘制都以指定的压力、温度以及除H+以外的其他物质的活度条件为前提。如果没有H+参与半电池反应,则还原-氧化反应可写成
pOx+ze
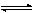 qRed (2)这是反应 (1)在n和c皆为零时的特例。此半电池反应的平衡电极电势为
qRed (2)这是反应 (1)在n和c皆为零时的特例。此半电池反应的平衡电极电势为 即反应(2)的平衡条件在指定压力、温度以及aOX和aRed下仅决定于电势而与pH无关,从而描绘在电势-pH图上为一根水平线。
即反应(2)的平衡条件在指定压力、温度以及aOX和aRed下仅决定于电势而与pH无关,从而描绘在电势-pH图上为一根水平线。②无电子得失的非还原-氧化反应可表示为
aA+nH+
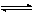 bB+cH2O (3)式中A、B分别为反应物与生成物;a、b、c、n均为化学计量系数。此反应的自由焓变量ΔGT可按下式计算:
bB+cH2O (3)式中A、B分别为反应物与生成物;a、b、c、n均为化学计量系数。此反应的自由焓变量ΔGT可按下式计算: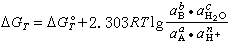 反应平衡时ΔGT=0,又a
反应平衡时ΔGT=0,又a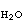 =1,于是
=1,于是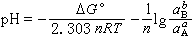 因为ΔG孏是化学反应的标准自由焓变量,在压力和温度恒定下为常数,所以在指定压力、温度以及aΑ和aB的情况下,反应(3)的平衡条件决定于pH,描绘在电势-pH图上是一条垂直线。
因为ΔG孏是化学反应的标准自由焓变量,在压力和温度恒定下为常数,所以在指定压力、温度以及aΑ和aB的情况下,反应(3)的平衡条件决定于pH,描绘在电势-pH图上是一条垂直线。电势-pH图的构成和说明 将上述两类共三种反应的平衡条件直线绘于一个图上,便是电势-pH图。对反应(1)与(2)而言,若电势高于其平衡电极电势,则反应的平衡被破坏,反应向生成物质氧化态的方向移动,有利于物质氧化态的稳定存在。相反,若电势低于反应的平衡电极电势,则有利于物质还原态的稳定存在。也就是说,电势-pH图中斜线与水平线的上方为物质氧化态的稳定区(或优势区),而下方为物质还原态的稳定区。同理,对反应(3)而言,若溶液的pH低于反应平衡pH,将有利于 B的稳定存在;相反,若溶液的pH高于反应平衡pH,则有利于A的稳定存在。因而,电势-pH图中垂直线以左的区域为B的稳定区,而以右的区域则为A的稳定区。可见,电势-pH图不仅以三种不同的线段反映了三种反应的平衡条件,而且由这些线段围成的区域也反映了物质各种形态稳定存在或相对优势的条件范围。从这个意义上,有些文献又称此图为物质优势范围图或优势区图。
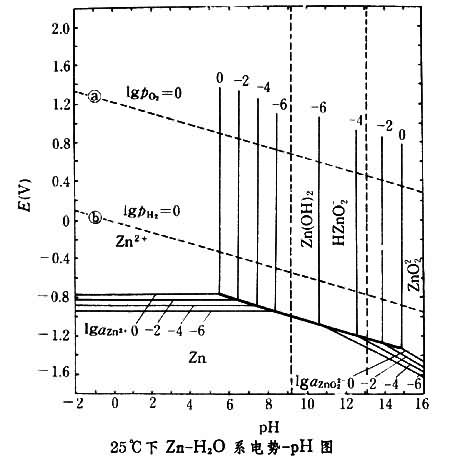
应用实例 作为水溶液反应热力学分析的一种图解法,电势-pH图有着重要的意义,已广泛应用于金属腐蚀与防腐、分析化学、地球化学以及湿法冶金等领域。下面举25℃下Zn-H2O系电势-pH图为例说明它在湿法冶金中的应用。
图中标示了离子Zn2+和ZnO娨的活度变化时,与这些离子有关的反应平衡条件的变动情况。图中a,b两条直线表示了下列两种反应的平衡条件:反应a.
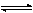 2H2O
2H2O反应b.
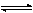 H2
H2或
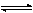 H2+2OH-
H2+2OH-图中以 a和b两条直线为界的区域是水的热力学稳定区,因为若电势与pH高于a线时水分解析出氧气,而若电势与pH低于b线时则水分解析出氢气。此图还说明,锌既可在酸性溶液中以Zn2+形态存在,也可在碱性溶液中以ZnO娨形态存在。从湿法冶金的角度来看,这一点说明既可用酸也可用碱从含锌物料中浸取锌。图中Zn2+稳定区相当大,Zn2+可以在接近中性的含酸溶液中稳定存在;这对锌的湿法冶金也很有意义,说明锌的浸取可在接近中性的溶液介质中进行,从而使某些易发生水解沉淀的杂质(例如Fe3+)在锌浸取过程中不随锌一起进入溶液而留在浸取渣中。从图还可以看到,若用电解法从含Zn2+溶液中提取金属锌,阴极电极电势必须低于Zn2+稳定区与Zn稳定区的分界线,而在这样低的电极电势下,H2的析出在热力学上是完全可能的;为了避免析出H2,以使锌电解有效而经济地进行,必须从动力学方面设法提高H2析出的超电势。由于b线远高于Zn2+与Zn的分界线,因而可以肯定,不可能用H2从硫酸锌溶液中将Zn2+还原成金属锌。
基于有关领域的实际需要,研究工作者在70年代运用了高温水溶液化学中有关离子热力学性质测定与计算的研究成果,绘制了各种金属-水系的高温电势-pH图,用来分析高温条件下的反应规律性。中国科学院化工冶金研究所已用电子计算机计算与绘制电势-pH图。
参考书目
M.Pourbaix,Atlas d'equitibres electrochimiques,Gauthier-Villars, Paris,1963.