碘(卷名:化学)
iodine
一种化学元素,化学符号I,原子序数 53,原子量126.90447,属周期系ⅦA族。
发现 1811年法国化学家B.库图瓦发现海藻灰溶液与硫酸作用后放出紫色气体,并研究了这种未知物的许多性质。后经H.戴维和J.-L.盖-吕萨克研究,正式确认库图瓦发现的是新元素,盖-吕萨克将它命名为iodine。它来源于希腊文ioeidēs,原意为“紫色的”。
存在 碘在地壳中的含量为3×10-5%。碘主要来源于智利硝石中的碘酸钠和碘酸钙;还以碘化物形式存在于海水、海藻、油井盐水和人体的甲状腺中。稳定同位素碘127是存在于自然界中的唯一同位素。


物理性质 在常温常压下,单质碘为紫黑色并带金属光泽的固体(见彩图);熔点113.5℃,沸点184.35℃,密度4.93克/厘米3。晶态碘有很高的蒸气压,加热时可以不熔化成液体而直接升华成气体(见彩图)。利用碘易升华的特性,可以制备纯碘。气态碘显深紫色,有刺激性气味。碘在水中的溶解度比溴和氯低,但易溶于碘化钾溶液以及四氯化碳、二硫化碳和苯中。
化学性质 碘的电子构型为(Kr) 4d105s25p5,氧化态有-1、+1、+3、+5、+7。碘溶于水很快发生水解:
I2+H2O
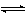 HIO+H++I-溶液显弱酸性,加酸可抑制水解;加碱则促进水解,因此碘易溶于碱:
HIO+H++I-溶液显弱酸性,加酸可抑制水解;加碱则促进水解,因此碘易溶于碱:I2+2OH-
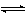 IO-+I-+H2O但是生成的次碘酸盐极不稳定,又歧化分解(见歧化反应)成碘酸盐和碘化物:
IO-+I-+H2O但是生成的次碘酸盐极不稳定,又歧化分解(见歧化反应)成碘酸盐和碘化物:3IO-
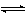 IO婣+2I-于是,总反应方程式为:
IO婣+2I-于是,总反应方程式为:3I2+6OH-
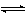 IO婣+5I-+3H2O在酸性介质中则发生此反应的逆反应。利用此逆反应可制备碘。
IO婣+5I-+3H2O在酸性介质中则发生此反应的逆反应。利用此逆反应可制备碘。在水溶液中,碘的氧化性比氯和溴弱得多,只有强还原剂硫化氢和硫代硫酸钠才能将它还原成碘离子:
I2+H2S─→S+2HI
I2+2S2O娫 ─→S4O婇 +2I-后一反应在分析化学中被用来测定碘。在水溶液中,强氧化剂可以将碘氧化成正氧化态的化合物。例如,氯可将碘氧化成氯化碘ICl或碘氯络离子ICl娛:
I2+Cl2+2Cl-─→2ICl娛氯也能将碘氧化成碘酸:
I2+5Cl2+6H2O─→2IO婣+10Cl-+12H+在碱性溶液中,过量的氯甚至能将碘氧化成高碘酸盐:
I2+7Cl2+24OH-─→2IO嵾+14Cl-+12H2O浓硝酸可将碘直接氧化成碘酸:
3I2+10HNO3─→6HIO3+10NO+2H2O
除贵金属外,固态碘可与其他所有金属化合成碘化物;可与电负性比它小的非金属化合成共价型(见共价键)的碘化物;与其他卤素作用,生成卤素互化物,例如IBr、ICl、ICl3、IF3、IF5、IF7等。
碘的典型有机反应有:芳香族化合物的亲电子取代反应,形成芳基碘化物;碘在不饱和烃的多重健上的加成反应。
极微量的碘与多羟基化合物淀粉相遇,立即形成深蓝色的配合物,这是定性检验碘的灵敏方法。
制法 主要生产方法是将智利硝石中的碘酸盐用亚硫酸氢钠还原:
2NaIO3+5NaHSO3─→3NaHSO4+2Na2SO4+I2+H2O海水、海藻灰和油井盐水中的碘化物可在硫酸介质中用二氧化锰氧化:
2NaI+MnO2+3H2SO4─→MnSO4+2NaHSO4+I2+2H2O也可用氯从碘化物溶液中置换碘:
NaI+Cl2─→I2+2NaCl
应用 碘对动植物的生命是极其重要的。海水里的碘化物和碘酸盐进入大多数海生动植物的新陈代谢循环中。在高级哺乳动物中,碘以碘化氨基酸的形式集中在甲状腺内,缺乏碘会引起甲状腺肿大。
碘主要用作消毒剂,如碘酒和碘仿CHI3;碘化物作为食物补充剂,用于治疗甲状腺肿大和心脏病;放射性同位素碘131(半衰期为8天)用于放射性治疗和放射性示踪技术(见碘标记化合物)。
参考书目
M.C.斯尼特等编,何兆雄等译:《无机化学大纲》,第3卷,上海科学技术出版社,上海,1963。(M. C.Sneedet al.,ed.,Comprehensive Inorganic Chemistry,Vol.3, Macmillan,London, 1953.)