化学平衡(卷名:化学)
chemical equilibrium
如果一个系统内各物质之间可以发生化学反应,则当达到平衡时,系统内各物质的量将不随时间而改变,此时称该系统达到了化学平衡,但这是一个动态平衡。系统的组成不随时间而变,并不意味着反应已经停止,而只是在任意时刻内,产物的生成速率和反应物的消耗速率相等。
当系统达到化学平衡后,只要环境条件不改变,平衡状态将不发生变化,系统的宏观性质也不会发生变化。环境条件(如温度、压力等)一旦改变,系统的宏观性质和物质的组成也将发生变化,达到一个新的平衡状态,称为平衡的移动。
平衡条件 用下式表示一个化学反应:
-vAA-vBB…
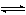 vXX+vYY+…或
vXX+vYY+…或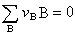 (1)式中vB是反应方程式中物质B的化学计量数,对反应物取负值,产物取正值。
(1)式中vB是反应方程式中物质B的化学计量数,对反应物取负值,产物取正值。当系统没有达到化学平衡时,系统内的各物质将按反应方程式的计量关系发生反应。为了描述各反应物质在反应过程中物质的量的变化,定义反应进度ξ 为:
dξ=vB-1dnB (2)式中 nB为物质B的物质的量。当反应进度改变dξ时,系统内各反应物质的物质的量的变化为:
dnB=vBdξ (3)如果反应系统为一封闭系统,且反应在等温等压条件下进行,则根据热力学函数基本关系式:
 (4)可以得到:
(4)可以得到: (5)
(5)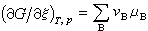 (6)式中μB为物质B的化学势;G为系统的吉布斯函数。根据吉布斯函数判断,当反应系统不作非体积功时,即
(6)式中μB为物质B的化学势;G为系统的吉布斯函数。根据吉布斯函数判断,当反应系统不作非体积功时,即 则反应可自动地正向进行;若
则反应可自动地正向进行;若 则反应不能自动地正向进行(而可以反向自动进行);当
则反应不能自动地正向进行(而可以反向自动进行);当 时,系统到达化学平衡状态。
时,系统到达化学平衡状态。1922年比利时化学家唐德尔定义:
 (7)A称为化学反应的亲和势,化学平衡的条件即为:
(7)A称为化学反应的亲和势,化学平衡的条件即为:A=0 (8)
平衡常数 当系统在一定条件下达到化学平衡时,产物和反应物的数量之间将保持一定的比例关系,可用“平衡常数“来描述这种比例关系。中国国家标准GB3102.8-82中,定义标准平衡常数K°为:
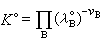 (9)式中vB为物质B的化学计量数;λ恖为物质B的标准绝对活度,其定义为:
(9)式中vB为物质B的化学计量数;λ恖为物质B的标准绝对活度,其定义为:λ恖=exp(μ恖/RT) (10)式中μ恖为物质B的标准化学势;R为气体常数;T为系统的热力学温度。将式(10)代入式(9),则标准平衡常数K°也可定义为:
 (11)
(11)标准平衡常数K°是无量纲的量。对一个指定的反应,K°仅仅取决于温度和标准态的选择。如果将一个化学反应写作不同的计量方程式,则因vB的改变,K°也不同,例如,将HCl(气)的合成反应写作:
 H2(g)+
H2(g)+ Cl2(g)─→HCl(g) (i)或
Cl2(g)─→HCl(g) (i)或H2(g)+Cl2(g)→2HCl(g) (ii)式中g表示气态,由于vB(ii)=2vB(i),所以

在不同聚集态物质的反应中,可以根据物质B的化学势的表达式,写出 K°的具体表达形式。例如,在气体混合物中,物质B的化学势可写作:
 式中g代表气相。气体混合物中的化学反应的标准平衡常数即可写作:
式中g代表气相。气体混合物中的化学反应的标准平衡常数即可写作: 式中T、p分别为反应系统的温度和压力;x啂 为反应达到平衡时,物质B在气体混合物中的物质的量分数;VB为平衡混合物中物质B的偏摩尔体积;R为摩尔气体常数;p°为标准压力(通常取 p°=101.325kPa)。如果反应气体均为理想气体,则
式中T、p分别为反应系统的温度和压力;x啂 为反应达到平衡时,物质B在气体混合物中的物质的量分数;VB为平衡混合物中物质B的偏摩尔体积;R为摩尔气体常数;p°为标准压力(通常取 p°=101.325kPa)。如果反应气体均为理想气体,则 ,式(13)可简化为:
,式(13)可简化为: (14)对于液相反应和非均相反应,也可以根据各种物质的化学势推导出相应的标准平衡常数的表达式。
(14)对于液相反应和非均相反应,也可以根据各种物质的化学势推导出相应的标准平衡常数的表达式。在实际应用时,为方便起见,还经常使用一些经验平衡常数来描述平衡混合物中各物质数量之间的确定关系。这些经验平衡常数的定义如下,对于理想气体反应:
 (15)x啂p=p啂即为平衡混合物中物质B的分压力。对于实际气体反应:
(15)x啂p=p啂即为平衡混合物中物质B的分压力。对于实际气体反应: (16)式中f啂 为平衡混合物中物质B的逸度,其定义为:
(16)式中f啂 为平衡混合物中物质B的逸度,其定义为: (17)对于理想液体混合物中的反应:
(17)对于理想液体混合物中的反应: (18)式中x啂 为平衡混合物中物质B的物质的量分数,对于理想稀薄溶液中溶质之间的反应:
(18)式中x啂 为平衡混合物中物质B的物质的量分数,对于理想稀薄溶液中溶质之间的反应: (19)
(19) (20)式中b啂 、c啂分别为平衡时溶质B的质量摩尔浓度和物质的量浓度。对液体混合物和溶液中的反应:
(20)式中b啂 、c啂分别为平衡时溶质B的质量摩尔浓度和物质的量浓度。对液体混合物和溶液中的反应: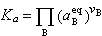 (21)式中a啂 为平衡时物质(溶质)B的相对活度。
(21)式中a啂 为平衡时物质(溶质)B的相对活度。上述经验平衡常数中 Kp、Kf、Kb、Kc都是有量纲的量。Kx、Kb、Kc、Ka不仅与温度有关,而且与压力有关。在低压条件下,上述经验平衡常数的数值可看作与其相应的标准平衡常数的数值近似相等。
标准平衡常数与温度的关系可由式(11)导出。将式(11)改写为:
 或
或 (22)将式(22)两边对T求导数:
(22)将式(22)两边对T求导数: 即
即 (23)式(23)中的
(23)式(23)中的 称为反应的标准摩尔焓变,其数值可由反应物质的标准摩尔生成焓或标准摩尔燃烧焓求出。
称为反应的标准摩尔焓变,其数值可由反应物质的标准摩尔生成焓或标准摩尔燃烧焓求出。一个化学反应的平衡常数是该反应进行限度的标志。化学反应平衡常数愈大,则此反应进行的程度愈大,或者说,反应物的平衡转化率愈高。因此,计算和确定反应的平衡常数是化学热力学的重要任务之一。
标准平衡常数的确定方法有:
① 利用实验的方法测定一个化学反应达到平衡时系统的平衡组成,然后根据K°的表达式求出其值。例如,根据式(13)及(14),气相反应的标准平衡常数可为:
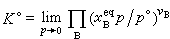 (24)在指定温度下,测定不同压力下平衡混合物的组成,求出
(24)在指定温度下,测定不同压力下平衡混合物的组成,求出 之值,然后外推到p=0,即可求得该温度下的K°值。
之值,然后外推到p=0,即可求得该温度下的K°值。② 利用反应的标准摩尔生成吉布斯函数定义:
 (25)ΔG妔称为反应的标准摩尔吉布斯函数变化。根据式(22),则得:
(25)ΔG妔称为反应的标准摩尔吉布斯函数变化。根据式(22),则得: (26)
(26) (27)因此,只要设法求得ΔG妔值,即可求出K°。由于μ恖的绝对值无法求得,不能直接利用式(25)求得ΔG妔。为此,人们采用了一个比较不同物质的μ恖的相对标准,规定在某一指定温度下,由稳定单质生成 1摩尔化合物的反应的ΔG妔 称为该化合物在此温度下的标准摩尔生成吉布斯函数,用符号ΔfG妔(B,T)表示。
(27)因此,只要设法求得ΔG妔值,即可求出K°。由于μ恖的绝对值无法求得,不能直接利用式(25)求得ΔG妔。为此,人们采用了一个比较不同物质的μ恖的相对标准,规定在某一指定温度下,由稳定单质生成 1摩尔化合物的反应的ΔG妔 称为该化合物在此温度下的标准摩尔生成吉布斯函数,用符号ΔfG妔(B,T)表示。例如,在298.15K时,反应
 的ΔG妔即为HC1(g)在298.15K时的标准摩尔生成吉布斯函数,记作ΔfG妔(HC1,g,298.15K)。
的ΔG妔即为HC1(g)在298.15K时的标准摩尔生成吉布斯函数,记作ΔfG妔(HC1,g,298.15K)。在任意温度下,稳定单质的ΔfG妔为零。对于一个任意的反应,
 ,则有:
,则有: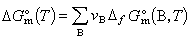 (28)式中
(28)式中 为在温度T时,反应的标准摩尔吉布斯函数变化;
为在温度T时,反应的标准摩尔吉布斯函数变化; 为物质B在温度T时的标准摩尔生成吉布斯函数。另外,也可利用下式:
为物质B在温度T时的标准摩尔生成吉布斯函数。另外,也可利用下式: (29)求得反应的
(29)求得反应的 。式中
。式中  分别为在温度T时反应的标准摩尔焓变与标准摩尔熵变。
分别为在温度T时反应的标准摩尔焓变与标准摩尔熵变。③ 利用电池的电动势求ΔG妔 。如果一个化学反应可以通过电池来完成,则有:
 (30)式中E°为电池在可逆放电时的标准电动势,即当电池反应中所有物质都处于各自的标准状态时电池的平衡电动势。此值可由组成电池的电极的标准电极电势求得,也可用实验测得;n为电池反应的电荷数;F为法拉第常数。
(30)式中E°为电池在可逆放电时的标准电动势,即当电池反应中所有物质都处于各自的标准状态时电池的平衡电动势。此值可由组成电池的电极的标准电极电势求得,也可用实验测得;n为电池反应的电荷数;F为法拉第常数。范托夫箱 为了计算一个化学反应在某一指定条件下的摩尔吉布斯函数变化ΔGm,荷兰化学家J.H.范托夫设计了一个如下的假想装置。假设有一个很大的箱子,如图所示。 其中放有 A、B、C、D等理想气体,这些气体在温度T下能发生下述反应:
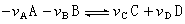 (31)
(31) 式中vA、vB…分别为A、B、…的化学计量数。假设箱中各气体已经达到化学平衡。其平衡分压分别为p啀 、p啂 、p啅 、p哠 。箱子上面有几个带活塞的唧筒,每个唧筒内可分别装一种气体,唧筒底部有半透膜与反应箱相连,该半透膜只允许该唧筒内气体通过,且可随时换成不透性的板壁。整个反应箱与温度为T的大热储器接触,以保持反应系统恒温。
式中vA、vB…分别为A、B、…的化学计量数。假设箱中各气体已经达到化学平衡。其平衡分压分别为p啀 、p啂 、p啅 、p哠 。箱子上面有几个带活塞的唧筒,每个唧筒内可分别装一种气体,唧筒底部有半透膜与反应箱相连,该半透膜只允许该唧筒内气体通过,且可随时换成不透性的板壁。整个反应箱与温度为T的大热储器接触,以保持反应系统恒温。设想通过以下步骤使箱中的化学反应可逆地进行:
① 在唧筒Ⅰ、Ⅱ中分别放有压力为pA的-vA摩尔气体A和压力为pB的-vB摩尔气体B,底部为不透性板壁。移动唧筒中活塞,使气体A、B的压力分别变为p啀、p啂。此过程为理想气体恒温过程。
② 把Ⅰ、Ⅱ、Ⅲ、Ⅳ唧筒的底部均换成半透膜,然后缓缓推下唧筒Ⅰ、Ⅱ的活塞,使-vA摩尔的A和-vB摩尔的B在平衡的情况下进入反应箱反应,同时缓缓抽动唧筒Ⅲ、Ⅳ的活塞,将反应生成的vC摩尔的C和vD摩尔的D可逆地逐渐抽出,以保持反应箱内各气体的平衡分压不变。由于上述反应在平衡状态下进行,所以ΔG=0。
③ 将各唧筒底部再换成不透性板壁,移动唧筒Ⅲ、Ⅳ的活塞,将其中的气体的压力分别变为pC、pD。
上述三个步骤可由下述途径表示:
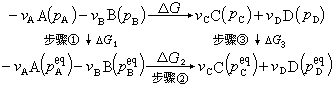 全部过程的吉布斯函数变化为:
全部过程的吉布斯函数变化为: 上式可改写为:
上式可改写为: 式中p°为标准压力(通常取101.325kPa)。等式右边第一项即为理想气体反应的标准平衡常数。
式中p°为标准压力(通常取101.325kPa)。等式右边第一项即为理想气体反应的标准平衡常数。 (33)将式(33)代入式(32),得到:
(33)将式(33)代入式(32),得到: (34)此式即为范托夫等温式。利用此式可以算出理想气体反应
(34)此式即为范托夫等温式。利用此式可以算出理想气体反应 的摩尔吉布斯函数变化ΔGm。
的摩尔吉布斯函数变化ΔGm。化学等温方程式 某一系统内有A、B、…等物质,且它们之间可发生下述反应:
 当反应系统处于某一指定状态,且反应进度变化为dξ摩尔时,有:
当反应系统处于某一指定状态,且反应进度变化为dξ摩尔时,有: (35)式中μB为物质B的化学势。
(35)式中μB为物质B的化学势。若反应系统中所有物质均为理想气体,则:
 (36)式中μ°(g,T)为气体B的标准化学势。pB为气体B的分压。p°为标准压力。将式(36)代入式(35)即得:
(36)式中μ°(g,T)为气体B的标准化学势。pB为气体B的分压。p°为标准压力。将式(36)代入式(35)即得: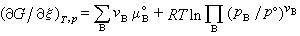 (37)再将式(11)代入,式(36)可改写为:
(37)再将式(11)代入,式(36)可改写为: (38)式(37)和(38)均称为化学等温方程式。
(38)式(37)和(38)均称为化学等温方程式。根据化学等温方程式,可确定当反应系统处于某一指定状态时,是否达到化学平衡或反应可能向何方向进行,根据式(38),当
 时,
时, ,反应可以自发地正向进行;当
,反应可以自发地正向进行;当 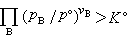 时,
时, ,则反应可以自发地向相反的方向进行;当
,则反应可以自发地向相反的方向进行;当 时,反应达到化学平衡。
时,反应达到化学平衡。 式(37)、(38)均只适用于理想气体反应。若反应物质为其他聚集状态,就可将相应的μB的表达式代入式(35),即可得到其他形式的化学反应等温式。例如,若反应物质均为实际气体,则得:
 (39)式中fB为物质B的逸度。代入式(35)得:
(39)式中fB为物质B的逸度。代入式(35)得: (40)若反应物质为理想稀薄溶液中的溶质,则得:
(40)若反应物质为理想稀薄溶液中的溶质,则得: (41)式中bB为溶质B的质量摩尔浓度;b°=1摩尔/千克,为标准质量摩尔浓度;V 悀为溶质B在无限稀薄溶液中的偏摩尔体积;p 为系统的压力。化学等温式为:
(41)式中bB为溶质B的质量摩尔浓度;b°=1摩尔/千克,为标准质量摩尔浓度;V 悀为溶质B在无限稀薄溶液中的偏摩尔体积;p 为系统的压力。化学等温式为: 若反应物质为溶液中的溶质,则得:
若反应物质为溶液中的溶质,则得: (43)式中aB为溶质B的相对活度。化学等温式为:
(43)式中aB为溶质B的相对活度。化学等温式为: 其他形式的等温式可用同样方法导出。
其他形式的等温式可用同样方法导出。勒夏忒列原理 当一个系统已经达到化学平衡时,如果外界条件(如温度、压力等因素)发生了变化,则系统的平衡状态将被破坏,平衡混合物的组成将发生变化,系统将重新达到一个新的平衡状态,这种情况称为平衡的移动。1888年法国化学家H.-L.勒夏忒列在研究了各种因素对化学平衡的影响之后指出:任何一个处于化学平衡的系统,当某一确定系统平衡的因素(如温度、压力、浓度等)发生改变时,系统的平衡将发生移动。平衡移动的方向是向着减弱外界因素的改变对系统的影响的方向。例如,若某反应为吸热反应,则当系统的温度升高时,平衡将向正方向移动,以吸收更多的热量,减弱温度升高的影响;若反应为放热的,则当系统温度升高时平衡将向逆方向移动,以减少反应过程放出的热量,减弱升温对系统的影响。再如,若反应过程是使系统的体积减小的,则当系统的压力增加时,平衡将向生成产物的方向移动,以抵消压力增加的影响。上述确定平衡移动方向的一般规则称为勒夏忒列原理。
勒夏忒列原理只是一个定性的、一般性的叙述,而且含义也不十分确切。实际上,各种因素对平衡的影响都可以从热力学的关系式中得到严格论证和计算。例如,根据平衡常数与温度的关系:
 当反应的ΔH妔>0时,则标准平衡常数K°随温度升高而增大,平衡混合物中产物的含量将增加。若反应的ΔH妔<0,则相反。其他因素对化学平衡的影响也可由相应的热力学关系式来探讨。
当反应的ΔH妔>0时,则标准平衡常数K°随温度升高而增大,平衡混合物中产物的含量将增加。若反应的ΔH妔<0,则相反。其他因素对化学平衡的影响也可由相应的热力学关系式来探讨。参考书目
傅鹰著:《化学热力学导论》,科学出版社,北京,1963。