钴(卷名:化学)
cobalt
一种化学元素,化学符号Co,原子序数27,原子量58.9332,属周期系Ⅷ族,为铁系(铁、钴、镍)元素之一。1735年瑞典G.布兰特发现并分离出钴。英文名来源于德文Kobalt,原意是妖魔。这可能是因为辉钴矿CoAsS含有砷,损害矿工的身体。
存在 钴在自然界分布很广,但在地壳中的含量仅为0.0023%,占第34位。钴矿主要为砷化物、氧化物和硫化物,它们是辉钴矿(CoAsS)、方钴矿(CoAs3)、砷钴矿(COAs2)、钴土矿(CoO·2MnO2·4H2O)、菱钴矿(CoCO3)、钴华(3CoO·As2O5·8H2O)、硫铜钴矿(CuCo2S4)和硫钴矿(Co3S4)。 许多铁、镍、铜、银、锰、锌矿都含有痕量的钴。海洋底的锰结核中钻的储量也很大。天然水、泥土和动植物中都发现有钴。自然界存在的稳定同位素为钴59。
物理性质 钴为有光泽的银灰色金属;熔点1495℃,沸点2870℃,相对密度8.9。金属钴具有铁磁性和延展性,在硬度、抗拉强度和机械加工性能等方面比铁优良。常温下金属钴为紧密的六方晶体,高于400℃时为面心立方晶体。
化学性质 钴的电子构型为(Ar)3d74s2,氧化态有0、+1、+2、+3、+4。钴的化学性质与铁、镍相似,在常温下与水和空气都不起作用,在 300℃以上发生氧化作用,极细粉末状钴会自动着火。钴溶于稀的盐酸、硫酸和硝酸,在发烟硝酸中表面形成一层氧化薄膜而被钝化。钴会缓慢地被氢氟酸、氨水和氢氧化钠所侵蚀。在加热时,钴与氧、硫、氯、溴发生剧烈反应,也能与一氧化碳形成羰基化合物。
钴的稳定简单化合物为+2价。简单的三价钴盐在低温时会被水还原成二价钴盐,简单的三价钴离子是强有力的氧化剂,三价钴的配位化合物在水溶液中稳定。二价钴和三价钴都容易与无机或有机配体形成稳定的配合物,如 Co
 、Co
、Co 、Co
、Co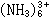 、Co
、Co 、Co
、Co 、Coedta2- 等(en为乙二胺,edta为乙二胺四乙酸根)。钴在配合物中的配位数为6,已知钴配合物的数量在金属中仅次于铂。由于水合作用、溶剂化作用或配位作用,溶液中许多钴盐呈现出明显的颜色变化。
、Coedta2- 等(en为乙二胺,edta为乙二胺四乙酸根)。钴在配合物中的配位数为6,已知钴配合物的数量在金属中仅次于铂。由于水合作用、溶剂化作用或配位作用,溶液中许多钴盐呈现出明显的颜色变化。化合物 ①氧化钴 有三种氧化物:一氧化钴CoO,又称氧化亚钴,为灰绿色粉末,有时为粉红色;熔点1795±20℃,相对密度6.45;不溶于水、醇和氨水,溶于酸或强碱的溶液。在非氧化性气氛中或隔绝空气的情况下,加热分解碳酸钴即得一氧化钴。它可做油漆颜料、陶瓷釉料和钴催化剂。三氧化二钴Co2O3又称氧化高钴,为黑灰色粉末;895℃时分解;相对密度5.18;不溶于水、醇,溶于浓酸。低温下在过量空气中加热亚钴化合物或氢氧化高钴均能得三氧化二钴,可做颜料和釉料。四氧化三钴Co3O4为钢灰色或黑色固体;相对密度6.07;900~950℃时分解成一氧化钴;不溶于水、盐酸、硝酸,溶于硫酸、熔融氢氧化钠。在空气中和 850℃以下加热钴盐即得四氧化三钴,可做颜料、催化剂和用来制备金属钴。
② 氢氧化钴 Co(OH)2 为粉红色固体;密度 3.597克/厘米3(15℃);加热分解;不溶于水,溶于酸和过量浓碱溶液;在空气中缓慢氧化成水合氧化高钴。水合氧化高钴用盐酸溶解时,三价钴离子氧化氯离子而还原成二价钴。氢氧化钴溶于氨水中,生成红色的钴氨配离子(见配位化合物)。可溶性钴盐溶液与氢氧化钠溶液作用,可制得氢氧化钴,可用于制钴盐和催化剂。
③ 二价钴卤化物 无水卤化物的颜色随氟、氯、溴、碘的顺序而加深:氟化钴CoF2为淡红色,氯化钴CoCl2浅蓝色,溴化钴CoBr2绿色,碘化钴CoI2黑色。它们可由金属钴与相应的卤素作用而得。在通常条件下,大部分钴的卤化物带六分子结晶水,呈不同程度的红色;除氟化物外,均易溶于水和乙醇。氧化钴、氢氧化钴或碳酸钴与相应的氢卤酸作用,可得水合卤化物(见水合物)。二价钴卤化物可用于氨气的吸收、电镀、肥料和动物饲料,也可做媒染剂和催化剂。卤化物中氯化钴较重要。六水合氯化钴为红色晶体;熔点86℃,相对密度1.924;在空气中易潮解;易溶于水、乙醇、乙醚和丙酮;加热到110℃时变成蓝色的无水氯化钴。无水物的熔点为 724℃,沸点1049℃,相对密度3.356;易吸水形成六水合物。在硅胶中加入一定量的氯化钴,可指示硅胶的吸湿程度,干燥时为蓝色,吸湿则转为粉红色。
④ 硫酸钴 CoSO4 七水合物为玫瑰色晶体;熔点96.8℃,相对密度1.948;420℃时失去结晶水,形成无水物。无水物为红或淡紫色粉末;熔点735℃(分解),相对密度3.71;溶于水和甲醇;与碱金属硫酸盐可形成复盐M
 [Co(SO4)2]·6H2O(MI为一价碱金属)。 硫酸钴在40%硫酸中的饱和溶液电解时,在阳极析出十八水合硫酸高钴Co2(SO4)3·18H2O。硫酸高钴易分解, 如果与碱金属硫酸盐形成硫酸复盐后就较稳定。硫酸钴可用于陶瓷、颜料、电镀、动物饲料,也可做催化剂和泡沫稳定剂。
[Co(SO4)2]·6H2O(MI为一价碱金属)。 硫酸钴在40%硫酸中的饱和溶液电解时,在阳极析出十八水合硫酸高钴Co2(SO4)3·18H2O。硫酸高钴易分解, 如果与碱金属硫酸盐形成硫酸复盐后就较稳定。硫酸钴可用于陶瓷、颜料、电镀、动物饲料,也可做催化剂和泡沫稳定剂。⑤ 八羰基二钴Co2(CO)8 为橘色或深棕色晶体;熔点51℃,相对密度1.78;不溶于水,微溶于醇,溶于乙醚、二硫化碳;高于熔点温度则分解成较稳定的黑色晶体Co4(CO)12。八羰基二钴由细钴粉在一氧化碳压力下直接反应而得,它可做汽油抗爆剂、催化剂和用来制高纯钴盐;吸入人体有毒。
制法 金属钴主要从钴矿中提取和冶炼。对于砷钴矿,可将矿石与焦炭、石灰石在鼓风炉内熔炼,富集金属,经粉碎、浸出、除杂质并氧化,以氢氧化高钴形式沉淀出来,加热变成氧化物,再用木炭加热还原成金属钴。对于氧化钴矿,可将矿石与焦炭、助熔剂在电炉中熔炼,生成含钴合金,用20%热硫酸溶解钴和铁,经除铁后以氢氧化高钴形式沉淀出来。对于铜钴硫化物矿,可将矿石焙烧转化成硫酸盐,用水浸出,以石灰乳调节pH到5.5,除去大部分铜和铁,残余的铜再用钴粒置换出来,纯化后的溶液用石灰乳调节pH到8.2,将沉淀出来的氢氧化钴溶于硫酸,经电解得到金属钴。
应用 钴产量的 80%用于生产各种合金。钴与镍、铬、钼、钨等元素的合金耐热性好,在高温下能保持原有强度和性能,广泛用于喷气飞机、燃气轮机和其他高温运转装置。含铬、钨等钴基合金非常硬,而且耐磨损、抗腐蚀,广泛用于切削工具和表面硬化工艺。用钴做碳化钨的基体或粘合剂,可改善硬质碳化钨的坚韧性和抗震性。大量的钴用来生产永磁性和软磁性合金,钴与稀土元素的合金是一种强力的永磁性合金。一些钴合金还可用作灯丝、弹簧和用于牙科、外科。人工放射性同位素钴60可代替X射线和镭检查物体内部结构,探测物体内部的裂缝或异物,也用于化学、物理、生物学的研究,并用来治疗癌症。钴化合物用于颜料、催干剂、催化剂和陶瓷釉料等。维生素B12是一种钴化合物,能抗恶性贫血。
参考书目
J. C. Bailar, ed., Comprehensive Inorganic Chemistry,Vol. 3, Pergamon, Oxford, 1973.