软硬酸碱理论(卷名:化学)
theory of hard and soft acids and bases
将酸和碱根据性质的不同各分为软硬两类的理论。1963年由R.G.皮尔孙提出。本理论适用于说明多种化学现象,如酸碱反应、金属和配位体间的作用、配离子形成(见配位化学),共价键和离子键的形成等。
简史 1958年S.阿尔兰德、J.查特和N.R.戴维斯根据某些配位原子易与Ag+、Hg2+、Pt2+配位,而另一些配位原子易与Al3+、Ti4+等配位, 将金属离子和配位原子分成a和b两类。a类金属离子包括碱金属、 碱土金属、高氧化数的轻过渡元素Ti4+、Fe3+、Cr3+和H+;b类金属离子包括较重的、低氧化数的过渡元素Cu+、Ag+、Hg2+、Pt2+。a类金属离子的特性随氧化数升高而加强,它优先与体积小、电负性大的原子结合;b类金属离子形成化合物的稳定性,因配位原子的电负性增大而减弱:
C≈S>I>Br>Cl>N>O>F此顺序几乎(不是全部)和 a类金属离子形成化合物的稳定性顺序相反(见表),如与水相比,硫醚R2S (R为烷基)与b类金属离子Hg2+、Pt2+、Pd2+等配位倾向较强。这个经验性总结有助于判断配位化合物的稳定性。

内容 皮尔孙在前人工作的基础上提出以软硬酸碱来区分a类和b类金属离子和配位原子。硬酸包括 a类金属离子,硬碱包括H2O、F-等;软酸包括b类金属离子,软碱包括H-、I-等;交界酸包括 Fe2+、Cu2+,交界碱包括NO娛、SO娫 等(表1)。

皮尔孙提出酸碱反应的规律为:硬酸优先与硬碱结合,软酸优先与软碱结合。这是一个很有用的经验规则。
应用 软硬酸碱理论可说明多种化学现象。
取代反应 酸碱取代作用倾向于形成硬-硬、软-软化合物:
HI(g)+F-(g)─→HF(g)+I-(g) ΔH=-263.6kJ/mol式中g为气态。H+是硬酸,优先与硬碱F-结合,反应放热。
双取代反应也倾向于生成硬-硬、软-软化合物,反应放热,如Li+、Be2+是硬酸(Be2+比Sr2+硬),F-是硬碱,I-是软碱,反应如下:
LiI+CsF─→LiF+CsI ΔH=-65.7kJ/mol
BeI2+SrF2─→BeF2+SrI2 ΔH=-200.8kJ/mol
化合物的稳定性 软-软、硬-硬化合物较为稳定。如软酸Cu+易与软碱CN-生成稳定的配位化合物(简称配合物)Cu(CN)娛,其稳定常数lgβ2=24,此值大于Cu+与硬碱NH3配合物Cu(NH3)娚的稳定常数(lgβ2=10.8);又如软酸Cd2+与软碱CN-的配合物Cd(CN)嵆的稳定常数lgβ4=18.9,大于Cd2+与硬碱NH3配合物Cd(NH3)娸的稳定常数(lgβ4=6.92);软碱I-易与软酸I2、Ag+形成稳定的I婣、AgI娛,而硬碱却不能形成稳定的I2F-、AgF娛。
一般软-硬化合物不够稳定,如CH2F2易分解:
2CH2F2(g)─→CH4(g)+CF4(g)
硬酸Mg2+、Ca2+、Sr2+、Ba2+、Al3+等在自然界的矿物都是与硬碱O2-、F-、CO娫、SO娸 等的化合物,而软酸Ag+、Hg2+等主要是与软碱S2-等的化合物。
高氧化数金属的化合物都是氧化物和氟化物,属硬-硬化合物,如OsO4、Mn2O7、IF7、OsF6;而某些低氧化数的金属与软碱的化合物比较稳定,如Mn(CO)5Cl。
溶解度 物质的溶解也是溶质和溶剂间的酸碱反应。常用的硬碱溶剂水和氨,较易溶解硬酸-硬碱的化合物,如LiCl、MgSO4、KNO3、…;而软碱溶剂如苯等,易溶解软酸Br2、I2。
软酸Ag+与硬碱F-的化合物易溶于水,而软酸Ag+与软碱Br-、I-的化合物难溶。Ag+与硬碱NH3配合物的稳定常数lgβ2=7.4。对软酸Ag+来说,碱的软性减弱顺序是:
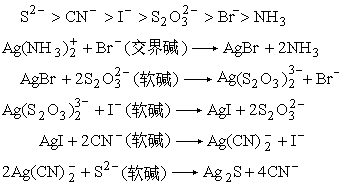
硬溶剂优先溶解硬溶质,软溶剂优先溶解软溶质。许多有机化合物不易溶于水,就是因为水是硬碱。
金属的电极电势
M(s)─→Mn+(aq)+ne式中s为固态;aq为水溶液。金属离子化倾向取决于三个过程的能量:
M(s)─→M(g) (升华)
M(g)─→Mn+(g)+ne (电离)
Mn+(g)+ne─→Mn+(aq)+ne (水合)式中g为气态。金属的升华、电离都是吸热过程,水合是放热过程。从能量角度看,反应的推动力是水合能。若Mn+是硬酸,则较易与硬碱(水)结合,金属的电极电势偏高;若Mn+是软酸,与水的结合力较弱,金属的电势相应偏低。对于软酸(如Ag+),如加入软碱(如 Br-等),因发生软-软结合,使金属的标准电极电势有所降低,如:
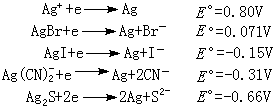
在液氨溶剂中,由于NH3不如H2O强,使某些硬酸的电势有所升高,而有些软酸的电势有所降低(与在水中的电极电势比),如表。

异性双基配体的配位情况 常见到的异性双基配体(见配位化合物)有 SCN-、SeCN-、 OCN-、CNO-、CN-、S2O娫、…等,它们与何种原子配位,也可以利用硬-硬、软-软结合规则来判断:Fe3+是硬酸,将与SCN-中“硬端”N原子结合成Fe(NCS)3,其他如表所示。

类聚作用 酸或碱的接受或给予原子的酸碱性受形成配合物时配位体软、硬性的影响。一般软配位体倾向于使酸、碱变软,而硬的配位体趋向于使硬性增强。如[CoF(NH3)5]2+比[CoI(NH3)5]2+稳定,因硬碱NH3加强了Co的硬性,使之更易与强碱F-结合。反之,若用软碱CN-代替硬碱NH3,加强了Co的软性,使 [Co(CN)5I]3-稳定,而[Co(CN)5F]3-则不能形成。
加合反应热效应 表2是水溶液中的几个酸碱反应实例,前六个都是硬酸-硬碱的结合,ΔH(焓变)的绝对值都不大,TΔS(T为温度;ΔS为熵变)是较大的正值,其正向反应的推动力是TΔS;软酸-软碱结合的ΔH为负值,TΔS也是较小的值。

在水溶液中,软酸-软碱、硬酸-硬碱类型的结合,其ΔH和TΔS值的差别与水合作用有关。H2O是硬性物,硬碱、硬酸原先都有强烈的水合作用,当硬酸和硬碱加合时,排挤出原先的水分子,使混乱度增高,即ΔS增大;而软酸、软碱原先的水合较弱,当较酸和软碱发生加合时,放热明显,愈软,放热愈多。例如,Hg2+是软酸,它与软碱 CH婣加合得CH3Hg+,后者与软碱RS-加合,放热更多。
催化反应 有机化学中的弗里德-克雷夫茨反应以无水氯化铝AlCl3作催化剂。AlCl3是硬酸,与RCl中的硬碱Cl-结合而活化:
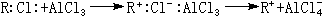 R+与苯核作用:
R+与苯核作用: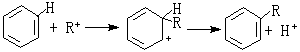 硬酸H+与AlCl嬄中的硬碱Cl-结合:
硬酸H+与AlCl嬄中的硬碱Cl-结合: 其他硬酸如SnCl4、FeCl3也有类似于AlCl3的作用。
其他硬酸如SnCl4、FeCl3也有类似于AlCl3的作用。金属催化剂中毒问题,也可从软硬酸碱规则来理解。一般零氧化数的金属都是软酸,易与软碱反应而中毒。如铁(软酸)催化剂,易与软碱如一氧化碳、硫、磷、砷等发生不可逆反应而引起铁中毒;硬碱如氧、水与铁发生可逆反应,不会引起铁中毒。
取代反应的速率 一般形成软酸-软碱化合物的反应速率较高。CH3Cl是软酸CH幦和硬碱Cl-的化合物,其中的CH幦能与软碱RS-、I-、S2O娫、R3P等发生较快的取代反应,而与硬碱RO-、R3N、F-、SO娸等的取代反应速率较低:
CH3Cl+RS-─→CH3SR+Cl-
CH3Cl+RO-─→CH3OR+Cl-前一个反应的速率是后者的100倍。
又如HI和AgF都是软-硬化合物。HI中的I-(软碱)与Ag+(软酸)发生快反应。同理,AgF 中的F-(硬碱)与Al3+(硬酸)也发生快反应:
HI+Ag+─→AgI+H+
3AgF+Al3+─→AlF3+3Ag+
为了统一酸碱软硬标度, 皮尔孙以H+(质子)作为硬酸、CH3Hg+(甲基汞离子)作为软酸的实验标准来测定它们与碱(B)反应的平衡常数,以决定碱的相对反应性能:
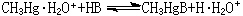
硬酸H+的参比平衡常数对数值lgK1的改变趋势与软酸CH3Hg+的参比平衡常数对数值lgK1的改变趋势恰好相反(表3)。这表明:酸碱软硬标度既与碱本身的性质有关,也和与之结合的酸的特性有关。
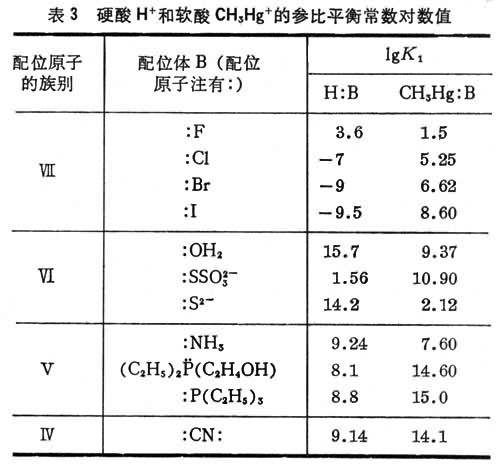
同理,可用标准硬碱和标准软碱为参比,测定与酸的相对反应性质。
参考书目
R.G.Pearson,Journal of Chemical Education, 45,pp.581~587、643~648, 1968.