胺(卷名:化学)
amines
氨分子中的氢被烃基取代而生成的化合物。
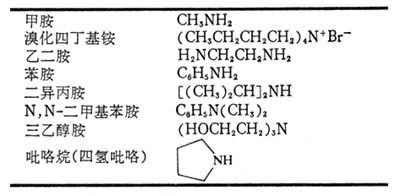
分类 按照氢被取代的数目,依次分为一级胺(又称伯胺)RNH2、二级胺(仲胺)R2NH、三级胺(叔胺)R3N、四级铵盐(季铵盐)R4N+X-,例如:
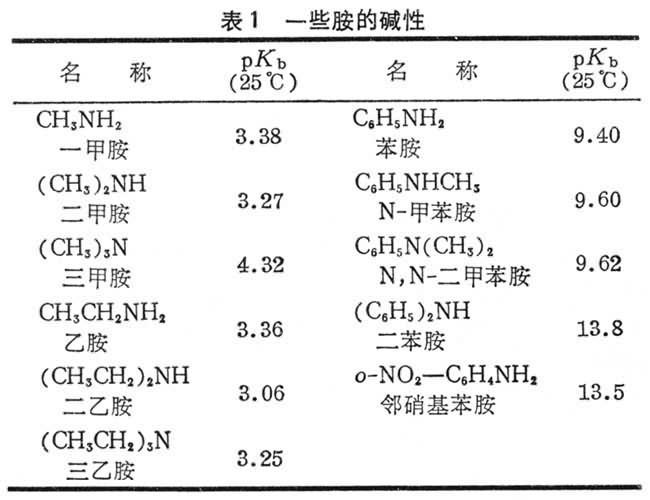
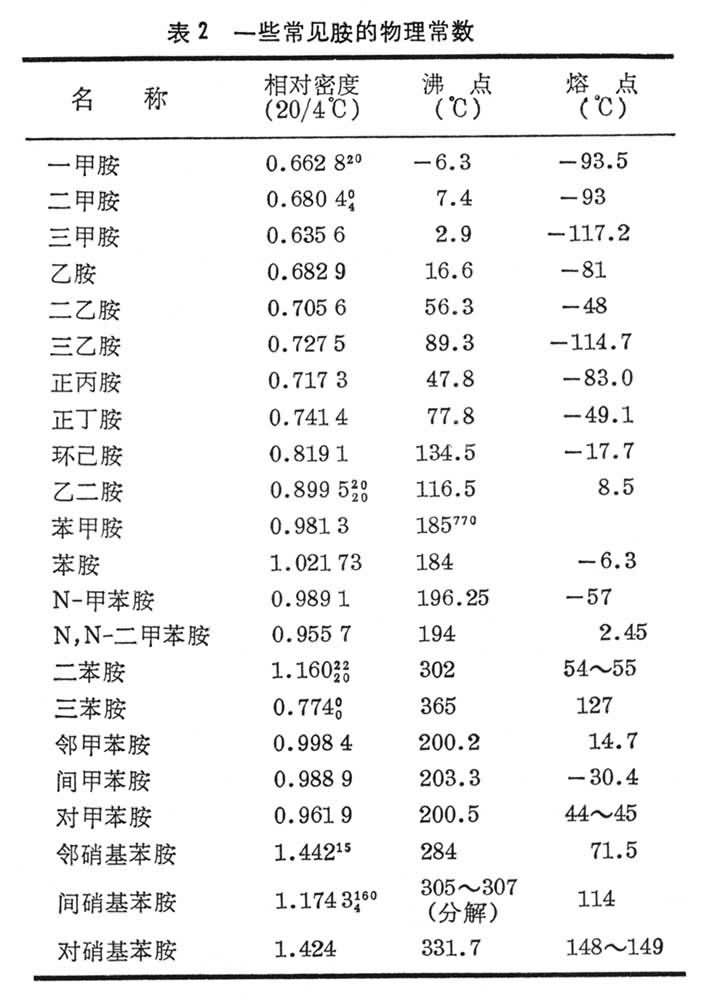
性质 胺具有碱性,在气相条件下,氨比任何一种甲胺的碱性都弱得多,但在溶液中其碱性与三甲胺相近,一甲胺和二甲胺的碱性较三甲胺约强10倍。一些胺的碱性见表1。氮原子具有较强的电负性,容易形成氢键,但这种氢键较弱,故胺与同级的醇或酸相比,其沸点较低。低级的胺是气体或易挥发的液体,气味与氨相似,有的有鱼腥味;高级的胺为固体;芳香胺多为高沸点的液体或低熔点的固体,具有特殊的气味。一些常见胺的物理常数见表2。
胺与酸作用易成盐。在许多有机反应中,常把胺作为亲核试剂使用。其反应活性通常随碱性的强弱而异,取代基的大小对反应活性的影响较大,位阻(见空间阻碍)较大的胺反应活性降低。例如,二异丙基乙基胺已完全不能与卤代烷发生作用。此外,芳香胺的重氮化反应也是重要的有机反应之一。
结构 胺中氮原子的结构,很像氨分子中的氮原子,是以三个sp3杂化轨道与氢或烃基相连接,组成一个棱锥体,留下一个sp3杂化轨道由孤电子对占据。如果一个胺有三个不同基团时,应有一对对映体(见对映现象):
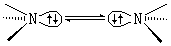 但由于翻转胺分子中的孤电子对所需要的活化能很低,未能分离出其对映体。
但由于翻转胺分子中的孤电子对所需要的活化能很低,未能分离出其对映体。制法 胺在自然界中分布很广,其中大多数是由氨基酸脱羧生成的,例如:
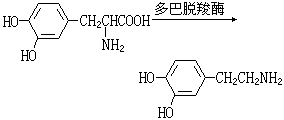 工业制备胺类的方法多是由氨与醇或卤代烷反应制得,产物为各级胺的混合物,分馏后得到纯品。由醛、酮在氨存在下催化还原也可得到相应的胺。例如:
工业制备胺类的方法多是由氨与醇或卤代烷反应制得,产物为各级胺的混合物,分馏后得到纯品。由醛、酮在氨存在下催化还原也可得到相应的胺。例如: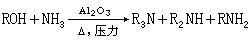
 工业上也常由硝基化合物、腈、酰胺或含氮杂环化合物催化还原制取胺类化合物,例如:
工业上也常由硝基化合物、腈、酰胺或含氮杂环化合物催化还原制取胺类化合物,例如: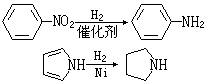
应用 胺的用途很广,在化学工业中占有重要的位置。最早发展起来的有机工业──染料工业,就是以苯胺为基础的。有些胺是维持生命活动所必需的,但也有些对生命十分有害,不少胺类化合物有致癌作用,尤其是芳香胺,如萘胺、联苯胺等都是烈性致癌物质。