金(卷名:化学)
gold
一种化学元素。化学符号Au,原子序数79,原子量196.96654,属周期系IB族。
发现 金在古代已被发现。埃及于公元前3000年已采集黄金,制作饰物。化学符号来源于拉丁文aurum,原意是“光辉的黎明”。中国古代用金与银的合金做装饰品,安阳殷墟出土的商代金箔薄到0.01毫米,金相考察证明在加工过程中曾经退火。
存在 金在地球上分布很广,通常含量太低,无开采价值。金在自然界中以游离金和碲化物矿形式存在。游离金存在于石英砂金中。碲化物矿有碲金矿 AuTe2、针碲金银矿AuAgTe和碲金银矿(Au,Ag)2Te。黄铁矿、黄铜矿中也有少量金存在。海水中的金浓度很小,每吨约含10微克。金在自然界只有一个稳定同位素金197。
物理性质 金为深黄色有光泽的贵金属;其熔点为1064.43℃,沸点3080℃,密度18.88克/厘米3(20℃);晶体结构为面心立方。金是热和电的良导体,延性和展性特别好,很容易被打成厚0.00001毫米的半透明金箔(见彩图)
 和拉成线密度只有 0.5毫克/米的金丝。在装饰品中金的品质以K(即开)表示,纯金为24K,将24乘以含金百分数即为饰品金质的K值,例如含75%金的饰品为18K。金能与大多数金属形成合金,最重要的是与银、铜形成的合金。金易溶于汞而形成汞齐。
和拉成线密度只有 0.5毫克/米的金丝。在装饰品中金的品质以K(即开)表示,纯金为24K,将24乘以含金百分数即为饰品金质的K值,例如含75%金的饰品为18K。金能与大多数金属形成合金,最重要的是与银、铜形成的合金。金易溶于汞而形成汞齐。化学性质 金的电子构型为(Xe)4f145d106s1,氧化态有+1、+3。金是极不活泼的金属之一,在任何温度下都不会被空气或氧氧化,也不会被硫侵蚀。金与强碱和所有纯酸(如硫酸、盐酸、硝酸、磷酸或砷酸)都不起作用,只有王水能溶解金:
Au+4HCl+HNO3─→HAuCl4+NO+2H2O将氧气通入氰化钾溶液也能溶解金:
4Au+8CN-+O2+2H2O─→4[Au(CN)2]-+4OH-金与干燥氯气一般不起作用,但与氯水反应:
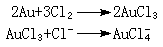 如无过量Cl-离子存在,则形成[AuCl3O]2-离子:
如无过量Cl-离子存在,则形成[AuCl3O]2-离子:2Au+3Cl2+2H2O─→2[AuCl3O]2-+4H+金能形成溶胶,根据金颗粒大小的不同,显示不同颜色,可以是红色、蓝色或紫色。用草酸、甲醛、葡萄糖作还原剂可使Au(Ⅲ)化合物还原成金溶胶。金位于电化序的末尾,在溶液中几乎能被所有金属置换,除非形成金的稳定配位化合物。金在化合物中以+3氧化态为最稳定,Au+离子容易歧化为Au3+和Au。Au+离子在水溶液中不能存在,而只能以配合物形式存在,如[Au(CN)2]-等。最常见的+3氧化态金的化合物是四氯金酸HAuCl4·4H2O和四氯金酸钠NaAuCl4·2H2O,它们都易溶于水,还能溶于乙醚或乙酸乙酯等有机溶剂中。氯化金AuCl3是红色晶体,固态和气态时为二聚体,溶于盐酸中生成HAuCl4,溶于水中生成H[AuCl3OH]。金的化合物均易受热分解。
制法 金主要以游离态存在。最古老的提取方法是漂洗法,常称“沙里淘金”。金还可用氰化物法提取,用0.2%氰化钠溶液在空气存在下使金形成配合物而溶解:
4Au+8NaCN+O2+2H2O─→4NaAu(CN)2+4NaOH再用锌还原成金:
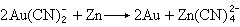 金的精炼是用AuCl3的盐酸溶液进行电解,纯度可以达到99.95%~99.98%。存在于铜矿中的金, 在铜电解精炼时留在阳极泥中,经过化学法或电解法精炼可制得纯金。
金的精炼是用AuCl3的盐酸溶液进行电解,纯度可以达到99.95%~99.98%。存在于铜矿中的金, 在铜电解精炼时留在阳极泥中,经过化学法或电解法精炼可制得纯金。应用 金的最大用途是黄金储备、装饰品和货币,占生产总量的75%。此外,在二极管和晶体管中可作引线的接触点和抑制器。利用金对辐射能的性质,已研制出红外加热器的能量反射器。金还可用以调节热量,镀金的窗玻璃可减少夏天热量的进入和冬天热量的损失。
毒性 金盐无毒,但若金中混有少量放射性杂质,沾在皮肤上会引起皮炎或皮疹。