双原子分子电子态(卷名:物理学)
electronic states of diatomic molecules
按照双原子分子电子的总角动量量子数和波函数的空间对称性来分类的分子状态。这种状态在一定程度上可以用双原子分子的电子组态来推断,但具体光谱项一般还需要进一步用电子光谱来决定。
分类和标记 轨道角动量 分子中两核的联线称为分子轴,两核产生的电场是轴对称的。电子在此轴对称的电场中运动时,其总轨道角动量L绕分子轴进动,它在分子轴上的分量取值为
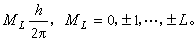 ML绝对值不同的电子系统有不同的能量,因此可用ML的绝对值Λ标记双原子分子的电子态:
ML绝对值不同的电子系统有不同的能量,因此可用ML的绝对值Λ标记双原子分子的电子态: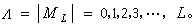 相应的电子态用大写希腊字母ч、∏、Δ、Ф、…表示,Λ=0的态记为ч;Λ=1的态记为∏……。Λ
相应的电子态用大写希腊字母ч、∏、Δ、Ф、…表示,Λ=0的态记为ч;Λ=1的态记为∏……。Λ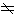 0的态是双重简并的,也就是
0的态是双重简并的,也就是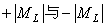 态简并,称为Λ双重态。
态简并,称为Λ双重态。自旋角动量 双原子分子电子光谱带具有多重结构,它来源于电子的自旋与磁场相互作用。在双原子分子中,各电子的自旋合成总自旋角动量S),自旋量子数S取整数或半整数,由电子数为偶数或奇数而定。Λ
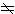 0时,电子的轨道运动形成一轴向内磁场,并引起S) 绕分子轴进动,S)在分子轴方向的分量是MS(h/2π)。将量子数MS记为 ч,其允许值为
0时,电子的轨道运动形成一轴向内磁场,并引起S) 绕分子轴进动,S)在分子轴方向的分量是MS(h/2π)。将量子数MS记为 ч,其允许值为ч=S,S-1,S-2,…,-S。对于一定的S值,有2S+1个不同的∑值。∑不同时分子能量稍有不同,电子光谱项因此分裂成2S+1个成分。Λ=0时分子没有轴向内磁场,若不考虑它的转动,光谱项不分裂。但不论Λ 是否为零,总把2S+1个值称为电子态(以及相应的光谱项)的多重性。
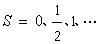 、的态分别称为单态、双重态、三重态等等。电子态的多重性标记在分子电子态符号的左上角,例如,
、的态分别称为单态、双重态、三重态等等。电子态的多重性标记在分子电子态符号的左上角,例如,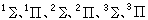 等。
等。总角动量 总角动量是总轨道角动量、总自旋的矢量和。当Λ=0时,电子的总角动量就是总自旋,此时总角动量的量子数Ω =S。当Λ
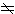 0时
0时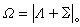
分子电子态的对称性 通过双原子分子轴的任一平面都是对称面,非简并态的电子波函数对这样平面的镜面反映或者不变、或者改变符号。前者所对应的电子态称为正,后者称为负。相应的标记为在电子态符号的右上角分别标记“+”或“-”。Σ态是非简并态,记为ч+或ч-。对双重简并的Λ
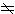 0的态就没有必要作这样的区分。当考虑分子的转动时,这种双重简并解除。
0的态就没有必要作这样的区分。当考虑分子的转动时,这种双重简并解除。对于等电荷核分子,波函数在中心反演 (r→-r)作用下,或者不变或者改变符号,前者称为偶态,后者称为奇态,在电子态符号的右下角分别用g和u表示,例如
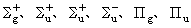 等等。
等等。分子轨道的单电子态 量子数λ 双原子分子中各电子在两核的电场和其他电子的平均场中运动,由于原子核的质量比电子的大得多,可将快的电子运动和慢的原子核运动分开处理,在计算电子运动时,可近似地认为分子中原子核保持某种固定构形,则其哈密顿算符是常数。取消原子核的动能算符而算得以核构形中各原子核坐标为参数的电子波函数,这就是玻恩-奥本海默近似。在初步近似中,可用单电子波函数来描述各电子的状态。电子的轨道角动量在分子轴方向分量的量子数ml被严格确定, ml=0、±1、±2、…。常用λ标记ml的绝对值 (λ=│ml│)。电子轨道角动量在分子轴上的分量的绝对值为λ(h/2π),λ=0,1,2,3,…,相应的电子分别称为σ、π、δ、嗞、…电子, 所有π、δ、嗞等λ
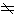 0的单电子态都是双重简并的。
0的单电子态都是双重简并的。分子轨道和原子轨道的相关 对于不等电荷核分子,当A、B两种核的距离趋于零时,就得到联合原子的极端情况,其核电荷数为ZA+ZB,此时电子态由原子的量子数n、l和λ=│ml│确定,λ=0,1,…,l。记为1sσ, 2sσ,2pσ, 2pπ, 3sσ, 3pσ, 3pπ,3dσ,3dπ和 3dσ等。当两核逐渐分开时,由于轴对称电场的作用,λ 不同的能级简并逐渐解除,n和l也逐渐失去了作用(但电子态的数目并不因此改变)。图1的左边表示联合原子轨道和分子轨道的这种相关情况。另一极端情况是假定两核分开无限远,得到分离原子近似。当A、B两原子靠近时,由于轴对称电场的作用,比较靠近并且λ值相同的原子轨道互相联合组成分子轨道。图1右边表示分子轨道和分离原子轨道的相关。从相关图可见,分离原子和联合原子的n、l值通常不一样,但它们之间有一定的关联。用联合原子的符号(1sσ 等)和用分离原子的符号(σ1sA等)来表示分子轨道是等价的。
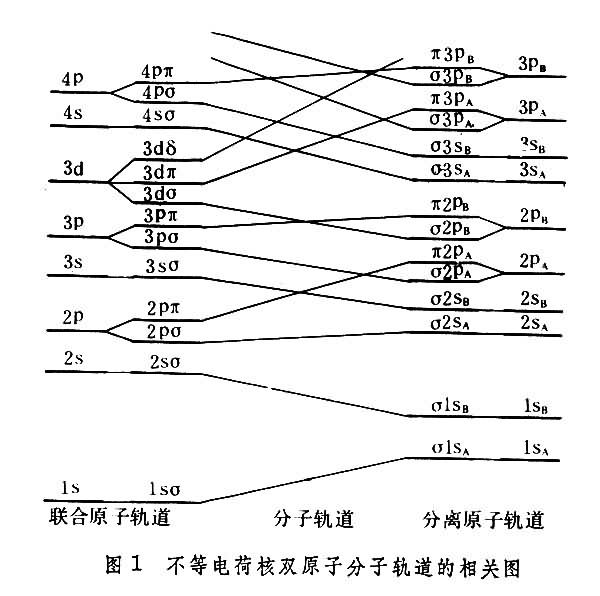
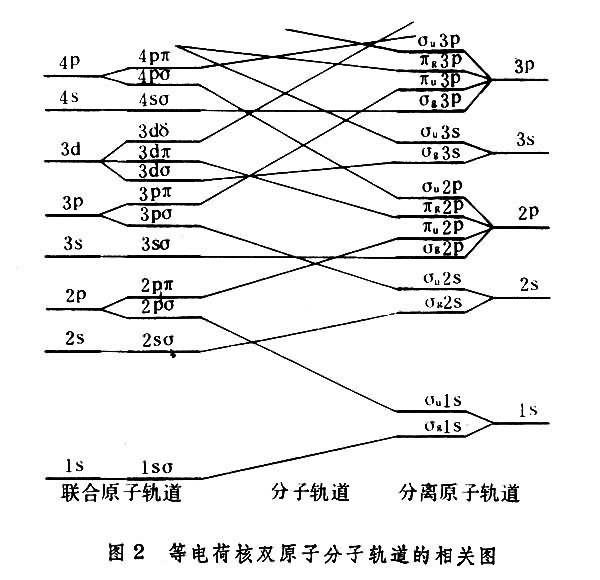
在两核电荷相等的情况下,电子波函数的中心反演对称性分为偶、奇两类,记为σg、σu、πg、πu等。在联合原子的情况,l为偶数的轨道为偶对称性,而l为奇数的为奇对称性。在分离原子的情况,n和l相同的两原子轨道具有相同的能量,可以组成偶对称或奇对称波函数,例如π2pA和π2pB组成πg2p或πu2p等。图2表示等电荷核双原子分子的分子轨道和原子轨道的相关情况。
双原子分子的电子组态 基态电子组态 根据泡利不相容原理,对一定的n和l的量子态只能有两个σ 电子
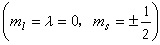 ,而对于π、δ、嗞等λ
,而对于π、δ、嗞等λ 0的量子态只能各有四个电子
0的量子态只能各有四个电子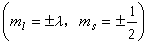 。基态的分子能量最低,电子首先填充能量较低的能级(参照图1、2的顺序)。不同的分子能级的顺序可能不一样。
。基态的分子能量最低,电子首先填充能量较低的能级(参照图1、2的顺序)。不同的分子能级的顺序可能不一样。从电子组态推断电子态 当已知电子组态时,可以根据一定的耦合模型来推断分子的电子态。
许多情形可采用罗素-桑德斯耦合模型(见LS 耦合)。因为满充支壳层Λ和S都为零,所以确定电子态时只需考虑未满充的支壳层。
不等电荷核分子的电子态偶、奇性取决于电子组态中奇态电子的数目。若奇态电子数为偶数时,分子的电子态为偶;奇态电子数为奇数时分子的电子态为奇。
以O2分子为例, 它的基态电子组态为(σgls)2(σuls)2(σg2s)2(σu2s)2(σg2p)2(πu2p)4(πg2p)2。其中未满充壳层是 (πg2p)2。两个 πg电子组成 Λ=2或0,S=1或0。其中Λ=2,S=1的态违反泡利不相容原理,因此只能组成
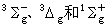 三个电子态,其中
三个电子态,其中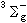 是基态。
是基态。