抗体(卷名:生物学)
antibody
能与抗原特异性结合并具有免疫活性的球蛋白。它一般是由抗原刺激 B细胞分化成浆细胞后产生的。抗体分子具有结合部位(结合簇),能与对应的抗原决定簇结合。抗体与不同的抗原结合往往出现不同的反应,因而常给抗体以不同的名称,如凝集素、沉淀素、抗毒素、溶血素、溶菌素等。1938年,A.蒂塞利乌斯和E.A.卡巴特用电泳技术发现,血清中的抗体活性存在于γ区,因而曾称其为丙种球蛋白。已证明抗体主要存在于γ区,有的抗体延至β甚至α区。位于γ区的球蛋白也不一定都具有抗体活性。1964年,世界卫生组织专门会议将具有抗体活性的球蛋白统一命名为免疫球蛋白(Ig)。抗体是Ig,但Ig不一定是抗体。
按来源抗体可分为天然抗体和免疫抗体。免疫抗体是由抗原刺激机体产生的,如受微生物感染或接种疫苗后产生的抗体;按其作用可分为抗毒素(能中和细菌外毒素毒性的抗体)、抗菌抗体(能与细菌结合的抗体)和抗病毒抗体(能与相应病毒结合的抗体);按其与抗原结合后是否出现可见反应,则可分为完全抗体和不完全抗体。前者指在试管中与相应抗原结合后,在电解质的参与下,出现可见反应的抗体;后者指在结合后不出现可见反应的抗体。
免疫球蛋白 存在于血浆中的、参与免疫反应的球蛋白。其组成、结构、大小、电荷、生物学活性等极不一致。已发现有5大类:免疫球蛋白G(IgG)、免疫球蛋白A(IgA)、免疫球蛋白M(IgM)、免疫球蛋白D(IgD)和免疫球蛋白E(IgE)(图1)。
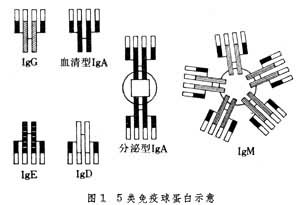
基本结构 Ig的基本结构相似,都是由两条相同的长肽链(重链)和两条相同的短肽链(轻链)通过二硫链连接而成。轻链可分成 κ型和 λ型,它们的氨基酸组成和抗原性不同;重链可分为γ、α、μ、σ和ε型,它们的氨基酸组成和抗原性也不同。在一个免疫球蛋白的分子中,两条轻链相同,两条重链也相同,没有混合型的。两条轻链通过链间二硫键分别与相邻的重链连接,两条重链再通过二硫键连接起来。除链间二硫键外,轻链和重链都各自有链内二硫键。轻链有两个链内二硫键,构成两个环肽,每环约有60个氨基酸残基;重链有4或5个链内二硫键,构成4或5个环肽,每环约有60个氨基酸,称为功能区。
每条重链或轻链又分为两个部分。以 IgG结构为例(图2),
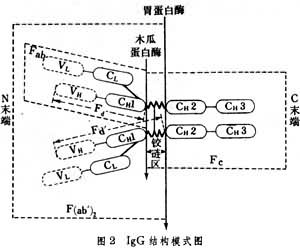 多肽链氨基端(N端)即轻链的1/2与重链的1/4,这个区氨基酸的组成及排列顺序,随抗体分子而千变万化,称为可变区(V区)。轻链V区简写成VL,重链V区简写成VH。多肽链羧基端(C端)即轻链的1/2与重链的3/4,这个区氨基酸的排列顺序比较稳定,称为恒定区(C区)。轻链C区简写成CL,重链C区简写成CH。VL和VH构成Ig的抗原结合部位,可与抗原呈特异的结合。在VL和VH区中,有些区域氨基酸的组成变化大,因而称为超变区或高变区。轻链上常有 3个超变区;重链上有 4个超变区。超变区与Ig的抗原结合部位的组成有关。恒定区与穿透胎盘、结合补体或吸附于细胞等生物性功能有关。
多肽链氨基端(N端)即轻链的1/2与重链的1/4,这个区氨基酸的组成及排列顺序,随抗体分子而千变万化,称为可变区(V区)。轻链V区简写成VL,重链V区简写成VH。多肽链羧基端(C端)即轻链的1/2与重链的3/4,这个区氨基酸的排列顺序比较稳定,称为恒定区(C区)。轻链C区简写成CL,重链C区简写成CH。VL和VH构成Ig的抗原结合部位,可与抗原呈特异的结合。在VL和VH区中,有些区域氨基酸的组成变化大,因而称为超变区或高变区。轻链上常有 3个超变区;重链上有 4个超变区。超变区与Ig的抗原结合部位的组成有关。恒定区与穿透胎盘、结合补体或吸附于细胞等生物性功能有关。水解分段 用木瓜蛋白酶可将IgG水解成3段:两个Fab段和一个Fc段。Fab段为能与抗原结合的部分,不过是单价的(一般抗体都是两价的),由一条轻链和靠N端的半条重链(称为Fd段)构成。如用胃蛋白酶水解,可将IgG重链间二硫键近C端切断,得到一个具有两价抗体活性的F
 段,还有Fc段的小部分(此时Fc段的大部分都水解成较小分子的肽,不呈现任何生物学活性)。
段,还有Fc段的小部分(此时Fc段的大部分都水解成较小分子的肽,不呈现任何生物学活性)。Fc段为 Ig分子中能够结晶的部分,由两个1/2重链(靠 C端)组成。每类Ig的特异抗原性都由它的Fc段来决定。
生物合成 Ig分子的实质是蛋白质,因而,它的生物合成与一般蛋白质相类似。所不同的只是一般蛋白质在生物合成时,总是由一个基因决定一条蛋白质的肽链,而FIg却是由两个基因决定它的一条肽链:一个基因决定该肽链的恒定区,另一个基因决定该肽链的可变区。决定恒定区的基因数目有限,决定可变区的基因数目非常大,这使Ig呈现多样性(见抗体的多样性)。
类别与作用 ①IgG:血清中最主要的免疫球蛋白,含量约占Ig总量的80%,正常成人血清中IgG含量为8~16毫克/毫升。大部分在脾脏和淋巴结的浆细胞内合成,积放于血液和组织液中。它是唯一能穿过胎盘的Ig,可保护胎儿和初生儿免受感染。正常人血清中的 IgG可再分为4个亚类:IgG1、IgG2、IgG3和IgG4。它们的氨基酸组成和结构不同,因而具有不同的抗原性和生物学功能。小鼠、大鼠、豚鼠、猪、羊、牛等的IgG都有亚类;②IgA:血清中的含量仅次于 IgG。分为血清型和分泌型两种。血清型IgA存在于血清中,分泌型IgA存在于粘膜分泌液(如泪液、鼻腔液、唾液、初乳以及气管、胃肠、生殖泌尿器官的分泌液)中。分泌型 IgA为局部粘膜防御机制的重要物质,因与局部免疫有密切关系,所以叫“局部抗体”。血清中的IgA有单体(沉淀系数 7S)和多聚体(9S、11S、13S)。分泌型IgA多为二聚体(11S),由两个或两个以上的单体经连接链(J链)连接起来。J链为一单链多肽,富含米胱氨酸,分子量约为2.5万。在分泌型IgA的分子中,除J链外,还有一个分泌片,简称SP。它是一种糖蛋白,分子量约为5.8万,可能有两种生物学功能,一是使分泌型IgA免受分泌液中某些蛋白质水解酶的水解,二是使IgA易于穿透分泌器官的粘膜进入分泌液。IgA有IgA1和IgA2两个亚类。两者的氨基酸组成、二硫键位置和抗原性都不相同。在血清中,IgA1约占80%,IgA2约占20%;但在分泌液中,IgA1和IgA2的含量大致相等;③IgM:由5个Ig单体(两条轻链和两条重链)构成,通过J链连接成“星形”的五聚体结构(图1)。分子量最大,所以又称巨球蛋白。主要存在于血液中,是血细胞、细菌等细胞型抗原诱生的抗体,冷凝集素、类风湿因子、梅素补体结合抗体等都是 IgM。1个IgM分子即可固定补体,因而能溶菌、溶血细胞,也能中和病毒,其作用比IgG约强100倍,所以属于高效能抗体。IgM是个体发育中最先合成的抗体,因此,检查IgM有助于传染病的早期诊断。IgM不能通过胎盘,若脐血中的IgM增高,则表示胚胎期会被感染;④IgD:主要存在于血清中,含量较低,平均每毫升血清中只有0.03毫升。性质不稳定,易被热和血液中的蛋白水解酶降解,半衰期很短(2~8日)。IgD存在于一部分脐带血B细胞表面,可能是B细胞表面的受体。其功能尚不清楚,对青霉素、胰岛素、乳蛋白、胞核抗原、甲状腺抗原等具有抗体活性。此外,在孕妇(特别是妊娠后期)、流行性出血热患者等的血清中,IgD明显升高。在自身免疫病中,IgD常是免疫复合物的成分之一;⑤IgE:又称反应素。在血清中含量极微,平均每毫升仅含0.00033毫克。半衰期最短(2~3日)。IgE是引起I型超敏反应的抗体,因对同种细胞有亲嗜性,故有亲同种细胞抗体之称。IgE的Fc段易与皮肤组织,尤其是易与血流中的嗜碱粒细胞、组织中的肥大细胞和血管内的皮细胞结合。抗原与IgE的F
 段结合后,Fc受体则发生变构效应,从而使肥大细胞、嗜碱粒细胞释放组织胺、5-羟色胺慢反应物质和缓激肽等药理活性物质引起一系列I型超敏反应症状。IgE主要是在呼吸道和肠道淋巴结中合成,然后进入外分泌液和血中。在哮喘和枯草热患者的鼻液和痰液中以及蠕虫病患者的血液中,IgE含量均较高。在荨麻疹、特发性皮炎和血管性水肿等患者的血中,IgE也常有增高现象。
段结合后,Fc受体则发生变构效应,从而使肥大细胞、嗜碱粒细胞释放组织胺、5-羟色胺慢反应物质和缓激肽等药理活性物质引起一系列I型超敏反应症状。IgE主要是在呼吸道和肠道淋巴结中合成,然后进入外分泌液和血中。在哮喘和枯草热患者的鼻液和痰液中以及蠕虫病患者的血液中,IgE含量均较高。在荨麻疹、特发性皮炎和血管性水肿等患者的血中,IgE也常有增高现象。异常免疫球蛋白 ①M成分:氨基酸组成和顺序十分均一的异常Ig,可在骨髓瘤、巨球蛋白血症或恶性淋巴瘤患者的血或尿中出现,为单克隆抗体形成细胞癌变增殖的产物。由于M成分是单克隆的Ig分子,所以其组成和结构十分均一,被广泛应用于Ig分子的一级、二级和三级结构的研究;②本周蛋白:某些多发性骨髓瘤患者尿中出现一种蛋白。1848年,因由英国医生H.本斯-琼斯发现而得名。这种蛋白具有一种特殊的物理性质:将患者尿加热至60℃左右,蛋白呈絮状,形成沉淀,继续加热至100℃,絮状沉淀又溶解(一般血浆蛋白加热到100℃时,絮状沉淀多结成块状),而在冷却后,絮状沉淀又出现。百余年来,一直不解这种蛋白的本质,直至1962年才由美国生物学家G.M.埃德尔曼阐明:本周蛋白是Ig的轻链,主要以轻链的二聚体形式存在。由于这种蛋白质的组成十分均一,由单克隆浆细胞产生,又能从尿中提纯,因此研究它的组成和结构对于了解Ig的组成、结构和功能有很大的帮助。正常人尿中也常有微量本周蛋白存在。