电解(卷名:化学)
electrolysis
在外电流作用下,使直流电通过电解槽,在电极界面引起化学反应的过程,即电能直接转变为化学能的过程。电解是在电解槽中进行的。用两块电子导体(如金属、石墨等)作为电极(阳极和阴极),在两极保持一定距离的情况下分别与离子导体(例如电解质溶液、熔融电解质等)直接接触,即构成最简单的电解槽。为防止阴极与阳极区的电解产物相混合,通常要在两极间加上可使离子透过的隔膜。
以水的电解为例,电解槽(见图)
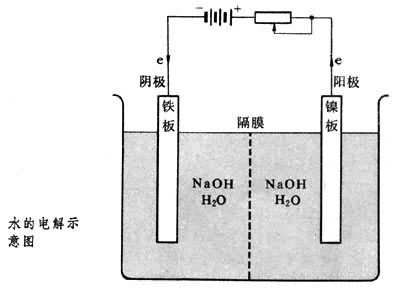 中的阴极是铁板,阳极是镍板,以氢氧化钠水溶液为电解液。两电极与直流电源接通后,电流流入阳极,然后由阴极流回到直流电源中。实际的电子流动方向与电流的方向相反,即电子自外电源流入铁阴极,随后转变为溶液中的离子输送电荷,接着又转变为镍阳极中的电子导电,最后将电子送回直流电源中。
中的阴极是铁板,阳极是镍板,以氢氧化钠水溶液为电解液。两电极与直流电源接通后,电流流入阳极,然后由阴极流回到直流电源中。实际的电子流动方向与电流的方向相反,即电子自外电源流入铁阴极,随后转变为溶液中的离子输送电荷,接着又转变为镍阳极中的电子导电,最后将电子送回直流电源中。在电流通过电解槽的过程中,在阴极的金属│电解质溶液界面上,应当出现阴极金属的电子导电向溶液的离子导电的转变,存在着电子消失的过程。在这个具体例子中,就是外电源输送给阴极的电子,将与溶液中的H2O分子相结合,形成氢气,称为阴极反应,这是个还原反应:
2H2O+2e
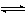 H2+2OH- (1)在阳极的金属│电解质溶液界面上,溶液的离子导电又要重新转变为阳极的电子导电,需要在界面上出现产生电子的过程,即溶液中OH-发生氧化而释放电子:
H2+2OH- (1)在阳极的金属│电解质溶液界面上,溶液的离子导电又要重新转变为阳极的电子导电,需要在界面上出现产生电子的过程,即溶液中OH-发生氧化而释放电子:4OH-
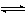 2H2O+O2+4e (2)这是个在阳极上发生的氧化反应。反应(1)与(2)之和就是整个电解水的反应:
2H2O+O2+4e (2)这是个在阳极上发生的氧化反应。反应(1)与(2)之和就是整个电解水的反应:2H2O
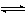 2H2+O2电解水就是在电流和电极界面电场作用下将水分解为氢和氧。
2H2+O2电解水就是在电流和电极界面电场作用下将水分解为氢和氧。电流通过电解槽时,不可避免地要在阴极发生还原反应和在阳极发生氧化反应。尽管电解液的成分相同,如果使用不同材料的电极,或在不同温度和电极电势下电解,则电极反应的速率甚至电解产物也都会不一样。
电解是一种非常强有力的氧化还原手段,可以把电子当作氧化剂或还原剂来看待。许多在一般情况下很难发生的氧化还原反应,常常可以通过电解来实现。例如,只有用电解的方法,才能将熔融的氟化物在阳极上氧化成单质氟。又如电解熔融的锂盐时,可在阴极上将很难还原的Li+ 还原为金属锂。许多已经实现大规模生产的电解过程,例如电解食盐水溶液制取氯气和烧碱(见彩图),电解熔融的氧化铝与冰晶石制取金属铝,电解精炼含杂质较多的铜等,经济上非常合算,在国民经济中具有重大意义。


与一般有机合成相比,有机化合物的电合成的最大特点是无需向体系中引入额外的氧化剂与还原剂,例如在阴极上将葡萄糖还原为山梨醇和甘露醇。这不但可以减少贵重化学药品的消耗,而且还可消除某些对环境污染的危害。电合成可以使某些稳定性差,不宜于在高温高压下进行的反应,得以在常温常压下进行。此外,在电合成中通过对电极材料的选择和温度与电极电势的控制,可以大大降低副反应的反应速率,简化生产中分离与提纯的操作。
为了解决环境污染和回收污水中的金属材料,电解也是处理污水的一种方法。由于污水中金属离子含量相当低,同样也需要在电解槽设计上作出新的改进,以增大电极表面积和促使电解液的流动。当前,除通常使用的箱式电解槽外,许多新型的电解槽,如板框压滤式电解槽、 旋转圆柱或多层圆盘电解槽、两极间距离小至0.3~1毫米的双极性电解槽、 阴阳极与隔膜叠在一起的卷筒式电解槽等,已陆续用于生产。
为了大量节约电能和提高自然资源的利用率,最近20年来,电解在工艺上的发展很快。例如,使用对电极反应催化性能好的新材料制备电极;在多孔圆柱中装入颗粒状电子导体材料,电解液自下部流入,形成流化床;由普通隔膜电解发展为离子交换膜电解,并将这种工艺进一步发展到两电极间的离子交换膜中几乎不存在夹带气泡的液体电解质(零间隙电解法)等。
参考书目
根文男著,安家驹、陈之川译:《电解槽工学》,化学工业出版社,北京,1985。(根文男:《電気化学反応と電解槽工学》,(株)化学同人,京都,1979。)