熵(卷名:化学)
entropy
一种热力学函数,通常用符号 S表示。熵的概念在经典热力学和统计热力学中是从不同的角度引入的。在经典热力学中,熵是为研究自发过程的方向性而引入的,它的含义比较抽象,一种定义式为:
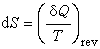 (1)式中δQ为热力学系统以可逆的方式从环境吸收的微量热;T为热力学温度。在统计热力学中,熵是一个系统所能实现的微观状态数的量度,它的定义是:
(1)式中δQ为热力学系统以可逆的方式从环境吸收的微量热;T为热力学温度。在统计热力学中,熵是一个系统所能实现的微观状态数的量度,它的定义是:S=klnΩ (2)式中Ω 为系统所能实现的微观状态的数目,即热力学几率,k是玻耳兹曼常数。
熵这个词最初是由德国物理学家R.克劳修斯提出的,它来自希腊文
 ,含义是“变化”或“发展”。熵的单位为焦/开。
,含义是“变化”或“发展”。熵的单位为焦/开。熵的性质 熵是一个广延性质的量,如果系统由几个部分组成,则总熵等于各部分熵之和。熵是一个状态函数,一个系统从一种状态变到另一种状态时伴随的熵的变化只与这种变化过程的始态和终态的性质有关,而与从始态到终态的途径无关,因此对循环过程,有:
 (3)
(3)在孤立系统中,熵总是增加的,除非达到了平衡态,熵不再变化,即有:
dS≥0 (4)
在封闭系统中,则有:
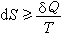 (5)等号适用于系统经历可逆过程的情况,不等号适用于经历不可逆过程的情况。
(5)等号适用于系统经历可逆过程的情况,不等号适用于经历不可逆过程的情况。在开放系统中,熵的改变dS可分为两部分:
dS=deS+diS (6)式中 deS表示系统与环境的物质或能量的交换过程对熵变的贡献;diS表示系统内部的不可逆过程的贡献。deS可正可负,但diS永远不会是负值:
diS≥0 (7)其中等号适用于可逆过程,不等号适用于不可逆过程。
熵增加原理 式(4)、 (5)和(7)可分别看作热力学第二定律在相应情况下的数学表述式,其中式(4)意味着一个孤立系统的熵永不减少。这一结论通常称为熵增加原理。这一原理的更一般的表述是:当系统经绝热过程由一种状态到另一种状态时,它的熵永不减少;熵的数值在可逆绝热过程中不变,在不可逆绝热过程中增加。
严格地说,熵增加原理的上述表述只适用于始态和终态是平衡态的情形。在始态和终态不是平衡态的情况下,系统的熵函数可能没有意义,因为在经典热力学中熵函数本身是通过平衡态定义的。但如果它们偏离平衡态的程度不是很大,则可以把系统分成许多小部分,每一小部分可以近似地认为处于平衡态,即局域平衡假设(见不可逆过程热力学),因而在每一小部分中熵函数存在。如果规定系统的总熵等于各部分熵之和,则熵增加原理仍然成立。
熵与其他状态变量的关系 对于封闭系统,如果只涉及体积功,从热力学第一定律和热力学第二定律可导出热力学中的一个基本关系式:
TdS=dU+pdV (8)式中 U为系统的内能;p为系统的压力;V为系统的体积。在导出这个关系式时已利用了可逆条件下的关系式 (5),但是只要系统内部处于平衡,且除了膨胀(压缩)过程以外系统内部没有其他不可逆变化(如不可逆化学反应),则无论膨胀过程是否可逆,关系式(8)都是适用的。
通过引入状态函数焓(H=U+pV),可以得到和式(8)类似的关系式:
TdS=dH-Vdp (9)从关系式(8)和(9)可以分别得到对于等容过程和等压过程的熵与温度之间的关系:
 (10)
(10) (11)式中CV和Cp分别为定容热容和定压热容。
(11)式中CV和Cp分别为定容热容和定压热容。利用关系式(8)和(9)以及熵是状态函数的性质,可以导出熵和压力及体积的关系:
 (12)
(12) (13)
(13)熵变的计算 对于可逆过程,可以直接从熵的定义〔式(1)〕来计算熵变,例如对于等温可逆过程,有:
ΔS=Q/T (14)式中 Q为系统从始态变到终态的过程中吸收的热量。对于不可逆过程,式(14)不再成立,但由于熵是状态函数,始态和终态确定以后,熵变的值便确定了。因此,可以通过设计一个从始态到终态的可逆过程来计算熵变。例如,对于等温过程,有:
 (15)此外,利用熵是状态函数的性质和关系式(10)~(13),可以计算更一般情况下的熵变。例如,对于均匀的并不涉及化学反应的封闭系统,有:
(15)此外,利用熵是状态函数的性质和关系式(10)~(13),可以计算更一般情况下的熵变。例如,对于均匀的并不涉及化学反应的封闭系统,有: (16)或
(16)或 (17)于是只要知道了热容、压力或体积与温度的依赖关系,便可计算熵变。例如,对于由状态(p1,V1,T1)到状态(p2,V2,T2)的变化过程(其中 p、V、T三个变量中只有两个是独立的),通过设计如下的可逆过程:先经等容过程(V=V1)从T1变到T2,再经等温过程(T=T2)从V1变到V2,利用式(16)可得到:
(17)于是只要知道了热容、压力或体积与温度的依赖关系,便可计算熵变。例如,对于由状态(p1,V1,T1)到状态(p2,V2,T2)的变化过程(其中 p、V、T三个变量中只有两个是独立的),通过设计如下的可逆过程:先经等容过程(V=V1)从T1变到T2,再经等温过程(T=T2)从V1变到V2,利用式(16)可得到: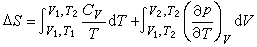 (18)与此类似,先经等压过程(p=p1)从T1变到T2,再经等温过程(T=T2)从p1变到p2,利用式(17)可以得到:
(18)与此类似,先经等压过程(p=p1)从T1变到T2,再经等温过程(T=T2)从p1变到p2,利用式(17)可以得到: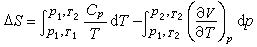 (19)
(19)熵的统计意义 从分子运动论观点来看,热力学系统的任何一种宏观状态总是对应于许多种微观状态。某一种宏观状态对应的微观状态的数目称为这种宏观状态的热力学几率。
原则上,系统允许的各种微观状态都是可以实现的,因而系统所能实现的宏观状态并不是唯一的。但是一种宏观状态所对应的微观状态的数目越多,即热力学几率越大,则实现这种宏观状态的几率越大。而自发过程是使系统从几率小的状态变成几率大的状态的过程。另一方面,按照热力学第二定律,对于孤立系统,自发的过程是使系统从低熵状态变成高熵状态的过程。因此,在一种状态的熵和这种状态的热力学几率之间存在着某种联系。这种联系的定量表达式是由L.玻耳兹曼于1877年提出的:
S=klnΩ式中Ω 为微观状态数;k为玻耳兹曼常数。上式表明体系的熵实质上就是体系所对应的微观状态数的定量量度,据此可从有关体系量子态的微观量求出相应熵的数值,为从统计力学求算热力学量奠定了基础。
上述关系式所表明的是 S与Ω 的联系。从熵变不可能确定体系的Ω 的绝对数值。热力学第三定律确定的所谓“绝对熵”并不是严格意义下的绝对熵值,而是只包括了随温度变化的那些运动形态(如平动、转动、振动)所贡献的熵,有时称为量热熵。尽管核自旋熵能够求得,但由于核自旋状态在通常化学变化的条件下不变,因而热力学第三定律所确定的绝对熵并不包括核自旋熵在内。
参考书目
J. A. Beattie and I. Oppenheim,Principle of Thermodynamics, Elsevier, Amsterdam, 1979.