氮(卷名:化学)
nitrogen
一种化学元素,化学符号N,原子序数7,原子量为14.006747,属周期系ⅤA族。
发现 1772年由瑞典药剂师C.W.舍勒和英国化学家D.卢瑟福同时发现,后由法国科学家A.-L.拉瓦锡确定是一种元素。nitrogen来源于希腊文 nitre,原意是“硝石”。
存在 氮在地壳中的含量约为0.0046%(重量),自然界中绝大部分的氮,以单质分子N2的形式存在于大气中,氮气占空气体积的78%。动植物体中也都含有元素氮,它是有机生命的重要组成部分。氮的最重要的矿物是硝酸盐,如南美洲智利的硝石NaNO3。氮有两种天然同位素:氮14和氮 15,其中氮14的同位素丰度为99.625%。
物理性质 单质氮在常温常压下为一种无色、无臭气体,熔点-209.86℃,沸点-195.8℃,气体密度1.25046克/升(0℃,1大气压),临界温度-146.95℃,临界压力33.54大气压。
化学性质 氮分子是由两个氮原子组成的,特别稳定。每个氮原子有三个自旋平行的2p电子。实验表明,氮分子中所有的电子在分子轨道中均是成对的。两个氮原子间生成一个σ键、两个π 键(见共价键),所以氮分子是很稳定的。氮分子的离解能为225.1千卡/摩尔。因为氮分子的反应活化能很高,在通常条件下,它对许多反应试剂是惰性的,但是氮分子的稳定性也是相对的。例如,一些植物的根瘤上的固氮菌能在常温常压下把氮分子转化为氮的化合物。
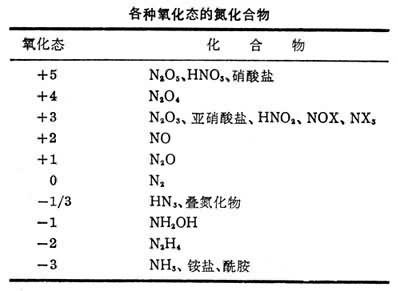
氮的电子构型为1s22s22p3,氮与其他元素化合时,可以表现为-3、-2、-1、+1、+2、+3、+4 和+5 氧化态。其中主要的氧化态是-3、+3和+5。各种氧化态的氮化合物见表,表中X为卤素。在某些氮的二元化合物中,有N3-离子存在。N3-离子只能存在于干态中,若遇水会立即水解,如:
Mg3N2+6H2O─→3Mg(OH)2+2NH3
在大多数氮的化合物中,氮是以共价键与其他元素结合的。在正氧化态中硝酸和硝酸盐是最稳定的化合物;而在负氧化态中NH嬃和NH3都是最稳定的。在高温高压并有催化剂存在下,氮和氢作用生成氨:
N2+3H2─→2NH3
化合物 ①氧化物 氮的电负性为3.04,低于氧。氮与氧反应时可生成不同的氧化物,如氧化二氮H2O、一氧化氮NO、二氧化氮NO2、三氧化二氮N2O3、四氧化二氮N2O4、五氧化二氮N2O5。除N2O5外,其余氮的氧化物在室温下都是气体。一氧化氮是无色气体,可溶于水,但无化学反应。N2O3不稳定,在常压下即分解为NO和NO2。N2O3是亚硝酸酐,溶于水即生成亚硝酸。亚硝酸是一种弱酸,很不稳定,易发生歧化反应。亚硝酸盐很稳定,除硝酸银外,其他亚硝酸盐易溶于水,亚硝酸盐有毒,是致癌物质。亚硝酸及其盐类是既有氧化性又有还原性的物质。NO2为红棕色气体,在低温下容易转化为无色的N2O4。随着温度的升高,N2O4转化为NO2的可能性增大。NO2溶于水,生成硝酸和亚硝酸。N2O5为白色固体,很不稳定,能发生爆炸性分解;溶于水可得硝酸。
②氮化物 为氮与电负性比它小的元素形成的二元化合物。在金属中,锂在常温下即与氮直接化合:
6Li+N2─→2Li3N而ⅡA族金属要在高温下才能与氮作用,如:
3Ca+N2─→Ca3N2过渡金属钪、钇、镧、锆、铪、钒、铬、钼、钨、锰在高温下也可生成氮化物。ⅠA族金属与氮直接反应,生成叠氮化物,受热后分解成氮化物Na3N、K3N、Rb3N等。400℃时这些氮化物分解为氮和相应元素,它们与水蒸气作用,放出氨,并生成金属氢氧化物,如:
K3N+3H2O─→3KOH+NH3氮也可与一些化合物作用,如:
CaC2+N2
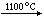 CaCN2+C
CaCN2+CNa2CO3+4C+N2
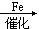 2NaCN+3CO使0.1~2毫米汞柱压力的氮气通过高压放电管时,它就部分地变成活化的不稳定状态,称为活化氮N壗,活化氮比通常氮活泼性更大:
2NaCN+3CO使0.1~2毫米汞柱压力的氮气通过高压放电管时,它就部分地变成活化的不稳定状态,称为活化氮N壗,活化氮比通常氮活泼性更大: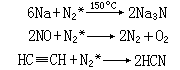
③分子氮配合物 部分过渡金属有与氮形成配合物(见配位化合物)的能力。在这些配合物中,一个氮原子的电子对与金属受体轨道形成的配键是很弱的。反过来,金属电子反馈到氮分子的受体轨道上,加强了配体和金属之间的键合作用。这对许多不饱和配体的配合物来说是重要的稳定因素。由于氮分子对金属的键合不很强,加热后就会失去氮分子。
惰性的分子氮转化为铵盐即可被植物吸收,许多植物的根瘤都含有这种固氮酶。目前世界上许多国家都在进行化学模拟和生物模拟固氮。
氮在自然界的循环 氮是组成动植物体中蛋白质的重要成分。大多数植物通过其根部吸收土壤中的铵盐和硝酸盐。一些豆科作物的根瘤上有固氮菌,它可以把大气中的氮转化为氮化物,然后被吸收,形成蛋白质。作物死后,这些化合态的氮又被其他植物、动物所吸收。
空气中存在单质氮和氧,在雷雨时,它们会发生反应,形成NO,接着又被氧化成NO2,NO2溶于雨水中形成硝酸和亚硝酸。这些酸与土壤中的金属化合物作用,变为硝酸盐和亚硝酸盐。在土壤中还存在着反硝化细菌,它们可以把硝酸盐、氨又转化为单质氮,从而又进入大气中。这个循环过程可用附图
 表示:
表示:虽然氮是一个生命元素,但高等动物及大多数植物不能直接吸收氮。但在高压下,氮可被吸入血液和器官中,有麻醉作用;当压力突然降低时,溶解的氮形成气泡,从器官中释放出来,使肌肉感到疼痛、无力,严重时可导致死亡。
制法 氮气的主要来源是空气,是由液态空气分馏而制得的。氮的沸点是-195.8℃,比氧的沸点低 13℃。工业上分馏液态空气时主要得到液氧,去掉氧便可得到氮。工业上常以 150大气压的压力将氮气装入钢瓶中运输和使用。实验室中制取氮气有以下各法:
NH4NO2
 N2+2H2O或可将饱和的亚硝酸钠 NaNO2逐滴加入热的饱和氯化铵NH4Cl溶液中制得。此外也可利用下列反应制取氮气:
N2+2H2O或可将饱和的亚硝酸钠 NaNO2逐滴加入热的饱和氯化铵NH4Cl溶液中制得。此外也可利用下列反应制取氮气:K2Cr2O7+(NH4)2SO4─→N2+Cr2O3+K2SO4+4H2O
2NH3+3CuO─→3H2O+N2+3Cu
8NH3+3Br2─→N2+6NH嬃+6Br-热分解Ba(N3)2或NaN3也可制得很纯的氮气:
Ba(N3)2
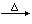 Ba+3N2氨在铂催化作用下可分解成氮和氢。
Ba+3N2氨在铂催化作用下可分解成氮和氢。应用 主要用来制造氨,其次是制备氮化物、氰化物、联胺、硝酸及其盐类。此外,可作保护性气体、泡沫塑料中的发泡剂,液氮可用作冷凝剂。