稀溶液的依数性(卷名:化学)
colligative properties of dilute solution
非挥发性溶质溶解在溶剂中后,其稀溶液的蒸气压下降、沸点升高、冰点降低、渗透压等值只与溶质的分子数有关而与溶质的种类无关,这四种性质称为稀溶液的依数性。
蒸气压下降 拉乌尔定律描述了非挥发性溶质溶解在溶剂中所引起的溶剂蒸气压下降:
ΔpA=p┱xB (1)式中ΔpA为溶剂的蒸气压下降值;p┱为纯溶剂的蒸气压;xB为溶质的摩尔分数。式(1)说明蒸气压下降只与溶质的摩尔分数有关,与溶质的种类无关。
沸点升高 液体蒸气压等于外界压力时的温度称为沸点,外压为1大气压时的沸点称为正常沸点。图1
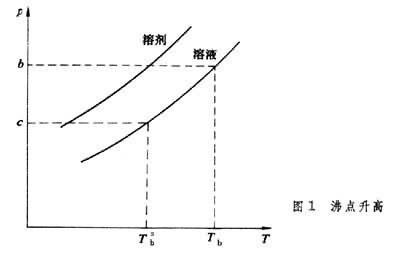 绘出溶液和纯溶剂的蒸气压曲线,在溶剂的沸点T
绘出溶液和纯溶剂的蒸气压曲线,在溶剂的沸点T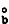 下,溶剂的蒸气压为b,溶液的蒸气压为c。欲使溶液的蒸气压达到b,必须将温度升高到Tb,Tb与T
下,溶剂的蒸气压为b,溶液的蒸气压为c。欲使溶液的蒸气压达到b,必须将温度升高到Tb,Tb与T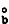 之差称为稀溶液的沸点升高:
之差称为稀溶液的沸点升高: (2)
(2)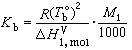 (3)式中ΔTb为沸点升高值;m2为溶质的浓度;Kb为沸点升高常数;R为气体常数;T
(3)式中ΔTb为沸点升高值;m2为溶质的浓度;Kb为沸点升高常数;R为气体常数;T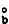 为溶剂的正常沸点;Tb为溶液的沸点;Μ1为溶剂的相对分子量;
为溶剂的正常沸点;Tb为溶液的沸点;Μ1为溶剂的相对分子量; 为溶剂的摩尔气化热。式 (3)说明沸点升高常数只是决定于溶剂的常数,因此, 当溶剂一定时沸点升高只与溶质物质的量有关,而与其他性质无关。
为溶剂的摩尔气化热。式 (3)说明沸点升高常数只是决定于溶剂的常数,因此, 当溶剂一定时沸点升高只与溶质物质的量有关,而与其他性质无关。1871年 F. -M. 拉乌尔从实验中发现沸点升高关系,1886年J.H.范托夫从热力学角度导出式(2),1889年E.O.贝克曼设计了更精确的实验加以证实。
冰点降低 冰点是固态纯组分1与溶液中的组分1达到两相平衡时的温度,即固态纯组分1的蒸气压与液态纯组分的蒸气压相等时的温度。图2
 绘出溶剂、溶液、纯固体的蒸气压曲线,溶剂与纯固体的蒸气压曲线在a点相交,对应的冰点为T懤;溶液与纯固体的蒸气压曲线在b点相交,对应的冰点为Tf,二者之差称为冰点降低:
绘出溶剂、溶液、纯固体的蒸气压曲线,溶剂与纯固体的蒸气压曲线在a点相交,对应的冰点为T懤;溶液与纯固体的蒸气压曲线在b点相交,对应的冰点为Tf,二者之差称为冰点降低:ΔTf=T懤-Tf=Kfm2 (4)
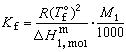 (5)式中ΔTf为冰点降低值;T懤表示溶剂的冰点;Tf为溶液的冰点;m2为溶质的浓度;Kf为冰点降低常数;R为气体常数;Μ1为溶剂的相对分子量;
(5)式中ΔTf为冰点降低值;T懤表示溶剂的冰点;Tf为溶液的冰点;m2为溶质的浓度;Kf为冰点降低常数;R为气体常数;Μ1为溶剂的相对分子量;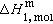 为1摩尔的溶剂由固态转变为液态的熔化热。式(5)说明Kf只与溶剂的种类有关,因此,冰点降低只与溶质物质的量有关,而与溶质的种类无关。
为1摩尔的溶剂由固态转变为液态的熔化热。式(5)说明Kf只与溶剂的种类有关,因此,冰点降低只与溶质物质的量有关,而与溶质的种类无关。1788年C.布莱格登发现冰点降低关系式(4),曾一度被称为布莱格登定律。1886年范托夫从热力学角度给予严格证明,导出式(5)。
冰点降低可用于测定未知物的相对分子量:
 (6)式中Μ2为未知物的相对分子量;W2为未知物的质量。虽然沸点升高法也可用于测定未知物的相对分子量, 但Kf》Kb,所以冰点降低法测定的准确性较高。实验室中常用的冰盐浴制冷剂也是根据冰点降低的原理。
(6)式中Μ2为未知物的相对分子量;W2为未知物的质量。虽然沸点升高法也可用于测定未知物的相对分子量, 但Kf》Kb,所以冰点降低法测定的准确性较高。实验室中常用的冰盐浴制冷剂也是根据冰点降低的原理。渗透压 用半透膜将纯溶剂和稀溶液或稀溶液和浓溶液隔开后,溶剂分子能从溶剂一边进入溶液一边的现象称为渗透。1827年法国生理学家H.迪特罗谢最早引入这一概念。渗透压指为阻止溶剂分子渗透而在溶液上方所需要施加的额外压力。1877年德国植物学家W.普菲费尔首次制出人工半透膜,并测定了蔗糖水溶液的渗透压。范托夫分析了普菲费尔的实验数据,于1886年提出渗透压公式:
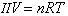 (7)式中Π为渗透压;V为溶液的体积;n为溶质的摩尔数;R为气体常数;T为热力学温度。显然,渗透压只依赖于溶质的量。
(7)式中Π为渗透压;V为溶液的体积;n为溶质的摩尔数;R为气体常数;T为热力学温度。显然,渗透压只依赖于溶质的量。用沸点升高和冰点降低法测定胶体溶质的相对分子量时,误差较大,所以常用渗透压法测定。渗透压对研究动、植物体的生命过程也有重要意义。