碱(卷名:化学)
base
通常指能抵消或中和酸,有涩味,能使紫色石蕊变蓝,在水溶液中电离给出氢氧基离子的物质。广义的碱指能给予电子对的物质(见酸碱理论)。碱一般为氢氧化物,还有碱金属的碳酸盐和碳酸氢盐、水玻璃、硫化钠等。
性质 强碱包括碱金属及钙、锶、钡的氢氧化物。它们都能溶于水,其固体或溶液能强烈吸收空气中的二氧化碳变成碳酸盐,遇过量的二氧化碳变成碳酸氢盐:
2NaOH+CO2─→Na2CO3+H2O
NaOH+CO2─→NaHCO3强碱固体还能吸收空气中的水分,所以强碱要密封保存,以防变质。盛碱的容器不能用玻璃塞,因为碱能腐蚀玻璃并可能将玻璃塞粘住。工业上把氢氧化钠盛在铁制容器中;实验室里通常在银、镍或铁质容器中进行有熔碱参与的反应。强碱溶液可保存在加盖的塑料瓶中。
其他氢氧化物都是弱碱,难溶于水,一般有以下五种性质:①成碱元素的氧化数愈高,其氢氧化物的溶解度愈小,如Fe(OH)3比Fe(OH)2更难溶,Ce(OH)4也比Ce(OH)3更难溶。②所有难溶的弱碱都能溶于酸,只是溶解所需的pH值不同。Fe(OH)3溶于pH<2的酸性溶液,Al(OH)3溶于pH<4.5的酸性溶液。③氢氧化物受热分解成氧化物和水。有些在室温下就能脱水生成氧化物,例如,温度在228K以上时,氢氧化银脱水成氧化银;有些须加热脱水,如氢氧化铜变成氧化铜;有的须在较高温度下脱水,如氢氧化铁变成三氧化二铁。④铝、锌、铜(Ⅱ)、镓、……等的氢氧化物呈两性,既溶于酸,又溶于碱。溶于碱时生成含氧酸盐,如铝酸钠NaAl(OH)4。⑤有些氢氧化物迅速被空气中的氧所氧化,如:
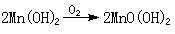
弱碱水溶液中存在电离平衡,以氨水为例,它的电离平衡式为:

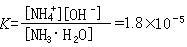 [NH嬃]、[OH-]、[NH3·H2O]为NH嬃、OH-、NH3·H2O的物质的量浓度,K是氨水的电离平衡常数。电离平衡常数表示弱碱的相对强弱。肼N2H4的K=8.5×10-7,表明肼的碱性弱于氨水。
[NH嬃]、[OH-]、[NH3·H2O]为NH嬃、OH-、NH3·H2O的物质的量浓度,K是氨水的电离平衡常数。电离平衡常数表示弱碱的相对强弱。肼N2H4的K=8.5×10-7,表明肼的碱性弱于氨水。由于在常温下纯水和稀水溶液中的[H+][OH-]=10-14,即使在碱性溶液中也有H+,不过[OH-]>[H+]。溶液中的[OH-]可用pOH表示,也可用pH表示。
制法 一般有四种方法:
① 电解食盐溶液制氢氧化钠:
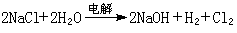
② 苛化法制氢氧化钠等:
Na2CO3+Ca(OH)2─→CaCO3+2NaOH
③ 碱土金属氧化物与水反应,如:
CaO+H2O─→Ca(OH)2
④ 氢氧化钠溶液与金属盐溶液反应,制备相应难溶的氢氧化物,如:
MgCl2+2NaOH─→Mg(OH)2+2NaCl也可用氨水代替氢氧化钠溶液制备除Mg(OH)2、Mn(OH)2以外的其他难溶氢氧化物。
应用 氢氧化钠(烧碱)和碳酸钠(纯碱)大量用于玻璃、肥皂、石油、纺织、造纸、净水、染料、制革、冶金等工业,被称为“二碱”。其中纯碱的用途更为广泛,直到20世纪50年代初,一个国家化学工业发展的水平,还是以硫酸和纯碱的年产量来衡量的。