化学热力学(卷名:物理学)
chemical thermodynamics
利用热力学定律研究化学反应的分支学科。主要包括热化学、化学平衡、溶液理论等,此外如电化学、表面化学、相平衡等也属于化学热力学范围。在研究化学反应时,需要知道反应的始态及终态的某些基本热力学性质(如内能、焓、熵、自由能、自由焓等)一般地说,如果始态(反应物)和终态(生成物)相对于适当参考态的焓和熵是已知的,则用热力学方法研究化学反应的条件就具备了。
热化学 主要内容是用热力学第一定律研究“化学反应热”方面的问题。在化学反应中,一摩尔物质的变化(指主要的生成物或反应物)所吸收的热量名为化学反应热,简称为反应热。根据热力学第一定律知道,在定温、定压(或定容)下发生的化学反应,其反应热Qp(或Qp)等于反应过程焓(或内能)的变化 ΔH(或ΔU)。所以方程
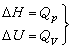 (1)是热化学中的基本热力学公式。利用态函数U、H 的性质,就可以从某些已知的反应热计算未知的反应热。
(1)是热化学中的基本热力学公式。利用态函数U、H 的性质,就可以从某些已知的反应热计算未知的反应热。由式(1)可见,反应热Qp(或Qp)仅由反应物的初始状态及生成物的终了状态所决定,而与中间过程无关,这称为赫斯 (Hess)定律。例如化学反应 C+O2─→CO2可以分
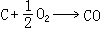 和
和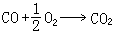 两步实现,若这三个反应的反应热分别为Qp、Qp1、Qp2,则
两步实现,若这三个反应的反应热分别为Qp、Qp1、Qp2,则Qp=Qp1+Qp2。赫斯定律是热力学第一定律的早期实验基础之一,它可以帮助人们从易于测定的Qp(或Qp)值,计算难于测定的Qp(或Qp)值;它是热化学中的重要定律之一。
反应热与温度的关系由基尔霍夫定律给出。它的内容是:定压下,在两个不同温度(T1和T2)进行的同一化学反应,其反应热Qp(T1)和Qp(T2)不同。由赫斯定律可导出反应热随温度的变化满足如下关系
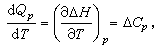 (2)式中ΔCp为生成物的定压热容和反应物的定压热容之差。式(2)就是基尔霍夫定律,它也是热化学中的一个重要定律。
(2)式中ΔCp为生成物的定压热容和反应物的定压热容之差。式(2)就是基尔霍夫定律,它也是热化学中的一个重要定律。化学平衡 主要内容是应用热力学的平衡判据研究化学反应的平衡条件。在化学热力学中通常把化学反应方程写作等式,例如,在化学热力学中将高温下氢分子和氧分子化合成水的反应式写为2H2O-2H2-O2=0。一般地,把任意一个化学反应写作如下形式
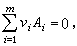 (3)式中Ai表示第i种组元。vi表示第i种组元在化学反应中的计量系数,并规定对生成物而言vi取正号,对反应物vi取负号。
(3)式中Ai表示第i种组元。vi表示第i种组元在化学反应中的计量系数,并规定对生成物而言vi取正号,对反应物vi取负号。对在不同条件下发生的化学反应,可使用不同的平衡判据。例如,在恒温、恒压、恒组成(N)下进行的化学反应,其自发进行(相应于下式中的小于号)或平衡条件(相应于下式的等号)由自由焓判据确定。即
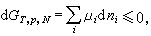 (4)式中μi为系统中某物种的偏摩尔自由焓(或称化学势),dni为该物种摩尔数的变化。
(4)式中μi为系统中某物种的偏摩尔自由焓(或称化学势),dni为该物种摩尔数的变化。由于化学反应
vAA+vBB+…─→vLL+vM M+… (5)发生时,各物种的数量变化dni要服从计量系数之间的比例关系,即
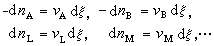 (6)式中ξ为反应进度,dξ为在一个无穷小过程中化学反应的进度。因而在式(4)中化学反应的自由焓判据为
(6)式中ξ为反应进度,dξ为在一个无穷小过程中化学反应的进度。因而在式(4)中化学反应的自由焓判据为dGT,p,N=(-vAμA-vBμB+vLμL+vMμM)dξ≤0 (7)或
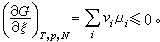 (8)
(8)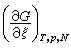 为在恒温、恒压、恒组成的系统中单位进度的反应(按计量系数的摩尔数发生的反应)产生的自由焓变值 Δ埥。为了满足恒组成的条件,可以设想系统非常大,因而发生了单位进度的化学反应后,系统的组成只变了无穷小量。Δ埥称为反应自由焓,-Δ埥称为化学亲合势。Δ埥越小(或-Δ埥 越大)则在该T、E、N(组成)时,反应趋势越大;Δ埥 等于零时,反应达到平衡。
为在恒温、恒压、恒组成的系统中单位进度的反应(按计量系数的摩尔数发生的反应)产生的自由焓变值 Δ埥。为了满足恒组成的条件,可以设想系统非常大,因而发生了单位进度的化学反应后,系统的组成只变了无穷小量。Δ埥称为反应自由焓,-Δ埥称为化学亲合势。Δ埥越小(或-Δ埥 越大)则在该T、E、N(组成)时,反应趋势越大;Δ埥 等于零时,反应达到平衡。当系统中没有产物时,产物的化学势为零;这时Δ埥=
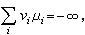 即正向反应趋势极大;反之,若反应物的浓度为零,则Δ埥=∞,即逆向反应趋势极大。在反应的过程中,组成不断变化,Δ埥值也随之变化,变化的情况如附图中所示,正向反应的Δ埥由AB曲线表示,逆向反应的Δ埥由A′B′曲线表示。R为反应物,P为产物。O点处Δ埥=0,所以O代表平衡混合物。
即正向反应趋势极大;反之,若反应物的浓度为零,则Δ埥=∞,即逆向反应趋势极大。在反应的过程中,组成不断变化,Δ埥值也随之变化,变化的情况如附图中所示,正向反应的Δ埥由AB曲线表示,逆向反应的Δ埥由A′B′曲线表示。R为反应物,P为产物。O点处Δ埥=0,所以O代表平衡混合物。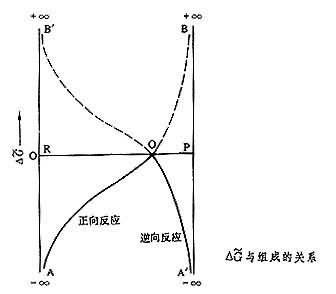
化学反应的平衡条件为
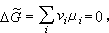 (9)μi为平衡系统中第i个组元的化学势。当系统为理想气体时,μi=μ孂(T)+RT lnpi。μ孂(T)为一个与温度有关的常数,称为标准化学势,Ei为平衡系统中第i个组元的分压,R 为摩尔气体常数。联合平衡条件式(9),可以得到平衡系统中各组元分压Ei之间的关系
(9)μi为平衡系统中第i个组元的化学势。当系统为理想气体时,μi=μ孂(T)+RT lnpi。μ孂(T)为一个与温度有关的常数,称为标准化学势,Ei为平衡系统中第i个组元的分压,R 为摩尔气体常数。联合平衡条件式(9),可以得到平衡系统中各组元分压Ei之间的关系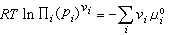 (10)或
(10)或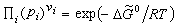 。 (11)
。 (11)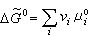 称为标准反应自由焓。由式 (11)知道,
称为标准反应自由焓。由式 (11)知道,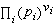 在恒温下为一常数,称为平衡常数, 以Kp表示
在恒温下为一常数,称为平衡常数, 以Kp表示Kp=
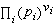 (12)和以上的论证相似,可以由μi与浓度
(12)和以上的论证相似,可以由μi与浓度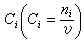 的关系得到
的关系得到 , (13)由μi与摩尔分数xi的关系可得出
, (13)由μi与摩尔分数xi的关系可得出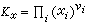 , (14)Ka,Kx是平衡常数的另两种表示方法。
, (14)Ka,Kx是平衡常数的另两种表示方法。当系统处于非平衡态时,设其组元的分压为E媴,则当
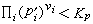 时,反应正向进行;当
时,反应正向进行;当 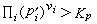 时,反应逆向进行。
时,反应逆向进行。溶液理论 用热力学方法研究多组元体系的理论。
溶液是液态溶体。溶体是一个含有两种或两种以上组元的均匀系。当溶体是气相时,通常叫做混合气体;当溶体是固相时,叫做固溶体。
在研究溶液性质方面,理想溶液是一个十分重要的模型。化学势具有以下形式
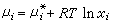 (15)的溶液称为理想溶液。式中xi表示组元 i在溶液中的摩尔分数;
(15)的溶液称为理想溶液。式中xi表示组元 i在溶液中的摩尔分数;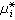 是温度T与压强E的函数。形成理想溶液的各组元在T、E不变的情形下混合时,总体积不变,也不吸收或放出热量,但其熵的变化为
是温度T与压强E的函数。形成理想溶液的各组元在T、E不变的情形下混合时,总体积不变,也不吸收或放出热量,但其熵的变化为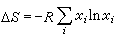 。实际溶液的性质与理想溶液的有差别,但非常稀的溶液,或化学结构极为相似的组元混合而成的溶液,均很接近理想溶液,例如苯和甲苯形成的溶液。此外将理想溶液服从的规律经过“校正”,就可以研究非理想溶液的性质。
。实际溶液的性质与理想溶液的有差别,但非常稀的溶液,或化学结构极为相似的组元混合而成的溶液,均很接近理想溶液,例如苯和甲苯形成的溶液。此外将理想溶液服从的规律经过“校正”,就可以研究非理想溶液的性质。理想溶液的蒸气压与组元浓度的关系服从喇乌耳定律。设溶液与其蒸气达到平衡,并把蒸气看作混合理想气体,其中第i组元的化学势为
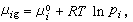 (16)μ孂是在温度T及1个大气压时第i组元纯气体的化学势。若在同温度时,此纯液体的蒸气压是E孂,则按照喇乌耳定律,有
(16)μ孂是在温度T及1个大气压时第i组元纯气体的化学势。若在同温度时,此纯液体的蒸气压是E孂,则按照喇乌耳定律,有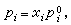 (17)式中xi为第i组元在液相中的摩尔分数。将式(17)代入式(16)可得
(17)式中xi为第i组元在液相中的摩尔分数。将式(17)代入式(16)可得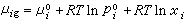 。 (18)由于在平衡系统中μi=μig,所以对比式(15)及式(18)得出
。 (18)由于在平衡系统中μi=μig,所以对比式(15)及式(18)得出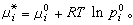 (19)在理想溶液中,任一组元从xi=0到xi=1都服从式(15),即无论是溶剂还是溶质,在整个浓度范围内都服从喇乌耳定律。
(19)在理想溶液中,任一组元从xi=0到xi=1都服从式(15),即无论是溶剂还是溶质,在整个浓度范围内都服从喇乌耳定律。常遇到的溶液是稀溶液,即其中一种组元的数量远远大于其他组元的数量。数量占得较少的溶质不服从喇乌耳定律而服从亨利定律
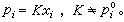 (20)因而对于溶质在式(15)中的
(20)因而对于溶质在式(15)中的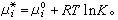 (21)
(21)除上述溶液的蒸气压受到溶质摩尔分数(或说浓度)的影响外,随着溶质浓度的增加,溶液的沸点升高而凝固点下降,这些性质在实际中均有重要应用。
非理想体系中各组元的化学势与压力(或摩尔分数)之间的关系比较复杂,但将理想体系中各组元的化学势的表达式加以“校正”,就可使其既适用于理想体系又适用于非理想体系,在形式上统一起来。为了达到这一目的,G.N.路易斯提出了逸度f与活度α的概念。在真实气体混合物中,用逸度fi代替理想混合气体中的分压Ei,则化学势表达为
μi=μ孂+RTlnfi。 (22)逸度f相当于“校正压力”,它与T、E及混合物的组成有关。与此相似,在溶液中用活度αi,代替第i组元的摩尔分数,则化学势表达为
μi=μ孂+RTlnai。 (23)活度αi是第i组元的化学势的量度,它与T、E及溶液的组成有关,相当于“校正浓度”。逸度与压力的比值称为逸度系数;活度与摩尔分数的比值称为活度系数。二者代表非理想体系与理想体系偏差大小的量度,可以通过实验方法测定。
参考书目
傅鹰编著:《化学热力学导论》,科学出版社,北京,1963。
S.Glasstone,Thermodynamics for Chemists, D.VanNostrand Co., Princeton, 1958.
G. W. Castellan, Physical Chemistry, Addison-Wesley, Tokyo, 1964.
M. L. Lakhanpal, Fundamentals of Chemical Thermodynamics, McGraw-Hill, New Delhi,1983.