臭氧(卷名:化学)
ozone
氧的同素异形体,分子式为O3。为天蓝色刺激性气体,液态呈暗蓝色,固态呈蓝黑色。1840年,德国化学家C.F.舍恩拜因在电解稀硫酸时发现一种特殊臭味的气体,其分子量是原子氧的三倍,即O3,并称它为臭氧。
存在 臭氧以不同含量存在于大气中:在农村的上空,靠近地球表面的浓度是0.02~0.03ppm;在城市,除了有烟雾的地方外,别处都较少。在离地面垂直高度15~25公里处有臭氧层,臭氧浓度高达0.2ppm。臭氧是由大气中氧的光化学作用产生的,但臭氧也能被某些化学物质,如氮的氧化物和氯的催化而分解,所以宇宙的变化和人类的活动,都有可能使臭氧减少。臭氧层能吸收太阳辐射中的大部分紫外线,从而保护了人类和其他生物,免受紫外线的伤害。
臭氧能刺激粘膜,对人和动物有害,在臭氧含量长期超过0.1ppm的空气中生活是不安全的。
化学性质 臭氧是比氧更强的氧化剂。一般情况下,它的氧化作用可以在较低的温度下进行。它能将硫氧化成三氧化硫,将银氧化成氧化银,将碘离子氧化为碘,后一反应进行得很完全,可用来定量测定臭氧。
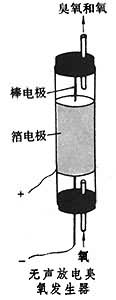
制法 使氧气或空气通过臭氧发生器即可产生臭氧(见图)。其他产生臭氧的方法有:电解低温浓硫酸;用铂丝在液氧中加热;以紫外线作用于氧气。
应用 臭氧可用作强漂白剂,其作用比过氧化氢、氯、二氧化硫都快。也可用于水的消毒,用后变成氧气,不像用氯消毒后有残留的气味。臭氧还用于有机合成(如壬二酸和制药工业中的某些中间体)。
参考书目
E.A.V.Ebsworth,J.A.Connor and J.J.Turner,The Chemistry of Oxygen,Pergamon Texts in InorganicChemistry, Vol. 16, Pergamon, Oxford, 1973.