银(卷名:化学)
silver
一种化学元素,化学符号Ag,原子序数47,原子量107.8682,属周期系IB族。
发现 银在古代已被发现。元素的化学符号来自银的拉丁文名argentum。5000~6000年前,埃及人已使用银。中国古代的琥珀金实际是银金合金(内含银、金、汞、铜、铂);春秋时期(公元前8~前5世纪)已有“错金银”工艺。
存在 银在地壳中的含量为1×10-5%~1×10-6%,居第63位,银的存在形式有自然银(见彩图)
 和银化合物矿,以及作为伴生元素存在于铜矿和铅矿中,银化合物矿有辉银矿(Ag2S)、角银矿(AgCl)、淡红银矿(3Ag2S·Ag2S3)、深红银矿(3Ag2S·Sb2S3)、脆银矿(Ag2S·Sb2S3)等。约有3/4的银来源于铅、铜、锑矿冶炼时的副产品。银在自然界有两种同位素,它们是银107和银109。
和银化合物矿,以及作为伴生元素存在于铜矿和铅矿中,银化合物矿有辉银矿(Ag2S)、角银矿(AgCl)、淡红银矿(3Ag2S·Ag2S3)、深红银矿(3Ag2S·Sb2S3)、脆银矿(Ag2S·Sb2S3)等。约有3/4的银来源于铅、铜、锑矿冶炼时的副产品。银在自然界有两种同位素,它们是银107和银109。物理性质 银为白色而有光泽的贵金属,质较软,比金硬;熔点961.93°C,沸点2212°C,密度10.5克/厘米3(20°C);晶体结构是面心立方。银是导电性和导热性最高的金属,20°C时的电阻率为1.63微欧·厘米;0~100°C时的热导率为425/瓦(米·开)。银的延展性仅次于金,是除金以外其他金属中最好的。热处理后银的伸长率是60%;冷处理后的伸长率降至7%。银的反光能力特别强,经抛光后,能反射95%的可见光。银能与铜、金、锌、铅、镉等金属形成合金。
化学性质 银的电子构型为(Kr)4d105s1,氧化态有+1、+2、+3。银是不活泼金属,一般与氧不起作用,在空气中表面能生成极薄的氧化膜。熔融态的银能吸收较多的氧,1份银吸收20份氧(体积比),冷却后仍保留0.75份。硫化氢或硫能使银的表面变黑。在常温下,卤素能逐渐与银化合。臭氧在约240°C时能直接与银反应,形成过氧化银。红热的银与氯化氢气体有如下反应:
2Ag+2HCl→2AgCl+H2银不与稀盐酸、稀硫酸或强碱反应,但能与硝酸和浓硫酸反应:
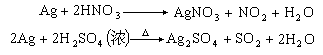 在有空气存在时,银易溶于氰化钾KCN溶液中,形成银氰配离子(见配位化合物):
在有空气存在时,银易溶于氰化钾KCN溶液中,形成银氰配离子(见配位化合物):4Ag+8KCN+O2+2H2O─→4K[Ag(CN)2]+4KOH这是氰化法从矿中提取银的基础。
银的主要氧化态为+1,如AgNO3、AgCl等;+2价化合物有AgF2、Ag(dipy)卂(dipy为邻联吡啶);+3价化合物少见,通常说的AgO,经中子衍射表明,实际是AgⅠAgⅢO2,为+1与 +3混合价。银化合物有含氧酸盐、卤化银、氧化银和硫化银等。硝酸银是重要的可溶性银盐,磷酸银为黄色粉末,难溶于水。卤化银有氯化银AgCl、溴化银AgBr和碘化银 AgI,三者都不溶于水;在氨水中AgCl、AgBr能溶,形成银氨配离子Ag(NH3)娚,AgI不溶。氧化银Ag2O为褐色粉末,几乎不溶于水。Ag2S呈黑色,是银盐中溶解度最小的。
一价银能形成许多稳定的二配位配位化合物,最重要的有银氨配离子 Ag(NH3)娚和银氰配离子Ag(CN)娛。前者由银盐加入氨水而得;后者由银盐加入过量氰化钠或氰化钾而得。
制法 从自然银和银化合物矿中提取银,都可用氰化法浸取。自然银在用氰化钠浸取时,须鼓入空气,才能形成银氰配离子:
4Ag+8NaCN+O2+2H2O─→4Na[Ag(CN)2]+4NaOH用氰化法浸取银的硫化物矿和氯化物矿时,可直接得到银氰配离子:
Ag2S+4NaCN─→2Na[Ag(CN)2]+Na2S
AgCl+2NaCN─→Na[Ag(CN)2]+NaCl用锌或铝还原银氰配离子时,可得纯度不高的银粉:
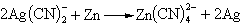 经熔化后铸成粗银块,再用电解法制成纯银。存在于铜矿和铅矿中的银,在铜电解精炼时留在阳极泥中,经过化学法和电解法精炼制得纯银。
经熔化后铸成粗银块,再用电解法制成纯银。存在于铜矿和铅矿中的银,在铜电解精炼时留在阳极泥中,经过化学法和电解法精炼制得纯银。应用 银的最大用途是与一种或几种其他金属制成合金。银铜合金可制作货币;银金合金用于珠宝饰物;银铜锌合金可用于银焊;银铅合金用于电池;银镉合金用于轴承。银的化合物用途很广。硝酸银可用于镀银和银镜;磷酸银可用作催化剂;卤化银可用于照相,碘化银还可用于人工降水;氧化银可用于玻璃抛光和着色,也可作催化剂和电极板等。
毒性 可溶性银盐,尤其是硝酸银进入人体会直接腐蚀胃肠。解毒方法是用食盐溶液使银变成氯化银沉淀。银化合物被人体组织吸收后,会使皮肤变黑。