骨(卷名:现代医学)
bone
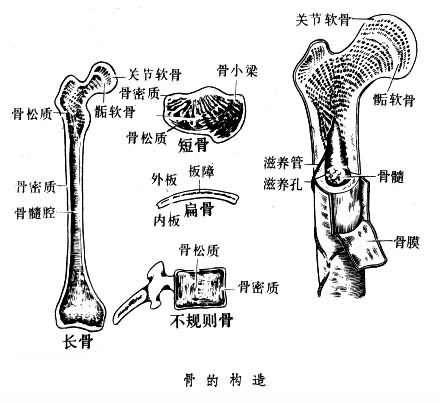
由坚硬而具弹性的骨组织构成的器官、全身骨互相连接构成骨骼、为运动系统的组成部分。骨髓又是造血组织。见于脊椎动物。成人有骨 206块。按部位可分为颅面骨、躯干骨和四肢骨,从形态可分为长骨(管状骨,如肱骨、股骨)、短骨(如腕骨、跗骨)、扁骨(如顶骨、骨盆骨)和不规则骨(如椎骨)。部份肌腱或韧带内(如手掌面、足蹠面)有卵圆形结节状小骨块,称为籽骨,用以代替部分关节面,变更、缓和所受压力,减少肌腱与骨面间的摩擦,改变骨骼肌牵引的方向等。籽骨一般仅数毫米大小,但髌骨是全身最大的籽骨。骨的变异甚多,有时邻近两骨可合并为一块,如寰椎与枕骨愈合;有时应合并的骨未能合并,如额骨分为两块。手、足骨部分偶见附骨(由几个骨化点形成的骨未愈合成一块,或出现额外的骨化点),故在阅读骨骼 X射线片时,应注意勿认为是骨折。各骨的大小、形态与其功能相适应。骨的表面由于肌肉的附着以及邻近肌腱、神经、血管的通过而形成转子、结节、突起、嵴、沟和切迹。骨外附有骨膜,内有骨髓腔,充以骨髓。
骨的主要功能为:①保护内脏器官、神经组织和功能间隙;②作为机体支架、支持体重、对抗重力;③提供坚固的运动链和肌肉附着点,在运动中发挥杠杆作用;④作为储存钙磷的仓库,以保持体内矿物盐平衡;⑤骨髓是造血组织。
骨分皮质骨(密质骨)和小梁骨(松质骨、海绵骨、髓质骨),皮质骨的疏松度为5~30%,而小梁骨为30~90%。长骨多呈管状,位于四肢游离部分。中间部分较长,称为骨干,内有空腔,即骨髓腔,含有骨髓。两端为骨端,在未发育成熟时称为骨骺,其表面为较薄的骨密质,内部为骨松质。骨干与骨骺相交处为干骺端。在具有复关节及具多数突起的骨有附加骨化点。短骨外面为密质骨,内部全为松质骨,起支持作用。扁骨多位于人体中轴及四肢肢带部,组成容纳重要器官的腔壁,起保护作用。骨的构造(见图)。长骨干的皮质由较厚的骨密质构成,皮质骨在内、外环板之间有多层同心圆排列的圆筒状骨板,其中心有一纵行管道,是血管、神经通路,这种由骨板和中心管道形成的结构称为哈弗斯氏系统或骨单位。
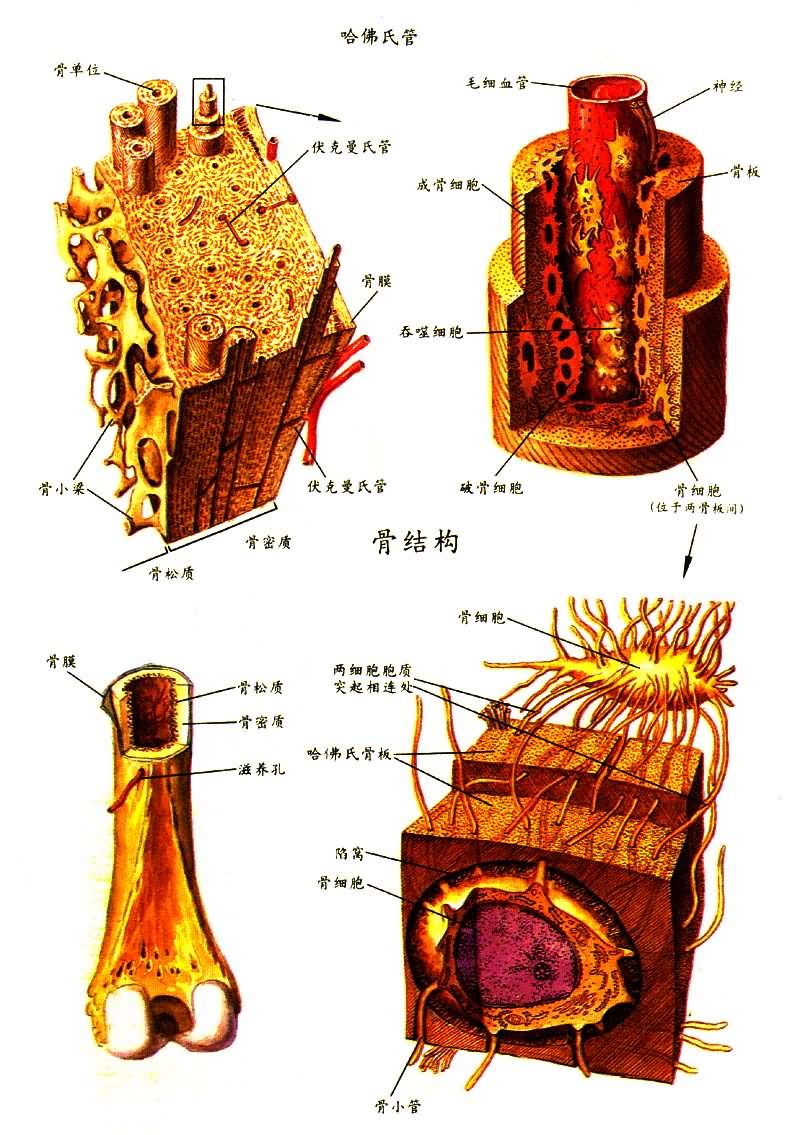
骨的附属组织有骨膜、骨髓、血管、神经等。骨膜分为骨外膜与骨内膜。骨外膜为包被在骨表面较厚致密的结缔组织膜,有粗大的胶质纤维束──沙比氏纤维,穿入骨质,起固定骨膜的作用。骨外膜内层的生骨细胞在幼年时非常活跃,可分化为成骨细胞,参与骨的形成;成年后处于静止状态,但终生保持分化能力,一旦骨折,可分化为成骨细胞,形成骨痂。骨内膜为薄层结缔组织膜,不仅衬附在骨髓腔面,也被附在骨小梁和哈弗斯氏管的内表面,具有分化为成骨细胞和破骨细胞的能力。骨髓充填于骨髓腔及骨松质的网眼内,由多种细胞及网状结缔组织构成,血管丰富,胎儿及幼儿的骨髓含大量不同发育阶段的红细胞及其他幼稚型血细胞,呈红色,称为红骨髓,有造血功能。5~7岁后红骨髓渐为脂肪组织代替,呈黄色,称黄髓。成年后仅扁状骨、不规则骨、长骨骨端的骨髓保留为红骨髓,具有制造与释放血细胞成分的作用。大量失血时,黄髓可转变为红骨髓,重新执行造血功能。
骨组织 骨组织由骨细胞和细胞外基质组成。
骨细胞系统的细胞 由间充质细胞分化而来,形成骨细胞谱系,包括生骨细胞、成骨细胞、骨细胞和破骨细胞。
① 生骨细胞。又称骨祖细胞或前成骨细胞是骨细胞谱系中的干细胞。生骨细胞经常存在于骨膜和哈弗斯氏管中,终身发挥作用,在正常骨生长与再建时,可分化为成骨细胞和破骨细胞;在骨缺损或骨折修复时,还可被激活分化为骨形成细胞。生骨细胞对已经分化的骨细胞还具有调整作用,例如成骨细胞和破骨细胞可恢复为生骨细胞。
② 成骨细胞。常呈单层上皮样覆盖于新生骨的表面,活跃时呈肥胖的立方形或圆形,静止时则呈扁平柱状,细胞之间以裂隙接合,表面有多数短绒毛状突起与相邻细胞相接。成骨细胞胞质丰富,呈强嗜碱性。成骨细胞有大量细胞器,充满发育良好的粗面内质网、线粒体,还有发达的戈尔吉氏体、核糖体、溶酶体、空泡与糖原颗粒等。这些细胞器有很强的蛋白质合成能力,产生有机机质。基质小泡由细胞膜或其突起形成,与钙化有关,含丰富的磷脂,可作为钙化触酶。约80%的碱性磷酸酶存在于基质小泡内,可产生大量PO婯。基质小泡含焦磷酸酶,能分解焦磷酸,消除其对钙化的抑制作用。基质小泡尚含三磷酸腺苷酶,分解三磷酸腺苷而产生能量,将细胞外的Ca2+向细胞内转运,浓缩。基质小泡分布于成骨细胞或骨细胞附近的类骨质中,破裂后,碱性磷酸酶能增加局部磷酸含量,磷质与钙有很强的亲和性,以钙盐结晶作为核心可使钙化范围逐渐扩大,而使类骨质迅速钙化。
③ 骨细胞。一旦成骨细胞包埋于由其分泌的骨基质中,即转变为骨细胞,位于骨间质中腔隙的骨陷窝内,由胞质发出突起与相邻骨细胞突起连接,通过骨小管从周围组织的血管获得营养。骨细胞呈弱嗜碱性,其细胞器大量减少,仅有少量粗面内质网和戈尔吉氏体,这说明其合成骨其质的能力已大大减少,骨细胞寿命有限,可逐渐衰老死亡。成熟骨细胞所在陷窝可以扩大呈不规则形,这种由骨细胞引起的溶骨活动也称为骨细胞性溶骨作用。
④ 破骨细胞。对其来源存在不同看法,有人认为可来自生骨细胞,目前更倾向于认为它来自淋巴细胞型的单核细胞,还有人认为它来自吞噬细胞、白细胞或造血性干细胞。破骨细胞为一种多核巨细胞,核的数目不一,平均为20~30个。多为不规则圆形或卵圆形,胞质嗜酸性。破骨细胞大小不等,形态不一,位于豪希普氏陷窝(即骨表面的浅腔)内,多见于骨塑建和再建以及骨基质被清除时。破骨细胞数量减少,只为成骨细胞的百分之一。
破骨细胞的骨吸收装置有皱折缘及透明区。皱折缘贴近骨表面,胞质边界不清,由多数指状突起和陷窝构成,其表面作小鬃毛样结构。透明区为与皱折缘相邻的特殊胞膜、包围在皱折缘的四周,犹如一道围墙。骨吸收装置通过溶酶体酶的分泌,提供骨吸收的酸性微环境,由水解酶先溶解骨的无机质,钙被移出,然后与被释放的胶原纤维一起通过皱折缘的小管被吸收到破骨细胞的空泡内,并由溶酶体进行消化。破骨细胞不在骨表面时,皱折缘与透明区均消失不见。
破骨细胞的归宿尚不明瞭,由破骨细胞转变为成骨细胞的证据似尚不足。可能其细胞核不断丢失又重新获得不断更新。
细胞间物质 包括有机的骨胶原、粘蛋白及无机盐。骨组织含有机质35%,无机质45%,水20%。在一生中,骨的物理特性,即有机质与无机质的比例随年龄增长不断改变。矿物盐沉积提供骨的硬度。以稀酸脱钙后骨就变得柔韧,易弯曲,甚至可以打结。将骨锻烧则成骨炭,变得十分松脆。幼年时骨组织中有机质多,骨柔韧性大,坚硬度差,易发生变形,老年人的骨组织中,无机盐相对多,脆而易折。
① 骨胶原。胶原的前身在成骨细胞的粗面内质网形成,转移到戈尔吉氏体合成原胶原,再经分泌性空泡排出细胞外,最后转变为胶原。胶原占骨全部有机质的93%。原胶原是胶原的分子单位,由三条 α-肽链相互拧成三联螺旋状构型的纤维蛋白质,主要由甘氨酸、辅氨酸、羟脯氨酸,赖氨酸,羟赖氨酸组成,其中近1/3为甘氨酸。每条 α-肽链由大约1000个左右的氨基酸残基组成。骨胶原属于 I型胶原,其肽链组成为 [α1(I)]2α2、 由成骨细胞分泌的可溶性原胶原分子长220nm,宽1.5nm,聚集形成排列规律而紧密的胶原原纤维,相互平行并连接,与相邻原纤维分子又相互重叠,其重叠部分占长度的1/4,约64nm,每个分子的末端与下一个分子始端存在裂隙,称为洞带,矿物质即初沉积于此。
② 粘蛋白。是碳水化合物与蛋白质的络合物,包括蛋白多糖和糖蛋白。蛋白多糖由氨基多糖和核心蛋白质组成。氨基多糖(粘多糖)是氨基己糖、葡萄糖醛酸和半乳糖组成的二糖单位的重复。糖蛋白中碳水化合物由共价链连在蛋白质上,具有非胶原性蛋白核心与双链的单糖。
③ 无机盐。分结晶体与非结晶体。结晶体主要为羟磷灰石,分子式为Ca3(PO4)6(OH)2或3Ca3(PO4)2Ca(OH)2长为20nm,平均截面积为5×5nm。另外还有碳酸钙,氟化钙,氯化钙等,占骨总重的60~70%,骨盐为细针状结晶,呈格式排列,沿胶原纤维长轴沉积。结晶体表面为水合壳,由羟磷灰石结晶结合水形成,外周为细胞间液,大量羟磷灰石结晶为骨组织与细胞间液钙离子提供广大交换面积,也为骨小梁和哈弗斯氏骨板提供很大交换面积,使钙磷比例保持在1.3~2:1。非结晶体位于羟磷灰石结晶表面,与钙离子结合在一起,主要为柠檬酸盐,对碳水化合物,脂肪和蛋白质化谢起重要作用,在三羧酸循环中被氧化而提供能量。无机盐的非结晶体尚含有钠、钾、氟、铅、锶和镁等离子。骨是钙、磷等的重要储存库,储存全身90%的钙,80%的磷,50%的镁和35%的钠。
钙盐沉积于骨基质中。在成骨细胞内含有细胞内总钙量的90%以上及总磷量的60%以上。钙离子可以通过线粒体膜进入戈尔吉氏体,并结合进入基质小泡,再输送至细胞边缘,最后排出,在细胞外钙化部位基质小泡膜被消化,钙磷离子被释放,使局部两种离子的浓度增加而引起钙盐沉积,以后变为丛状的钙球,经过不断融合扩大,最后成为骨细胞。
钙盐仅沉积于骨基质而不沉积于其他组织。对这种特异性,有其局部与全身因素两个方面。骨基质的钙化需要在特殊部位有足够的钙磷离子,携带至特殊的空间排列,并需要特殊条件以完成成核作用。
钙化与蛋白多糖复合物有关。蛋白多糖在软骨开始钙化前增加,而在钙化进行时下降。肥大的软骨细胞、成骨细胞及年轻的骨细胞含有碱性磷酸酶,可作用于有机磷酸复合物,使局部磷酸根增多,加上组织液原有足量的钙磷离子,使局部钙磷乘积大于40,有利于类骨质钙化。
身体内组织中的焦磷酸盐能抑制体液中的钙磷离子结合为磷酸钙,还能制止后者成为羟磷灰石。但焦磷酸酶的作用不仅可解除上述焦磷酸的抑制作用,还可为局部增加一定量的磷酸根。当然,成核作用还需要有甲状旁腺激素、降钙素及 1,25-(OH)2 D3(1,25-二羟胆骨化醇)调节细胞及其泵系统,改变钙离子的活性,产生相应的反应,使储存的钙达到正常水平。
基质小泡内的钙盐沉积不仅发生在生理情况下的软骨内骨化及膜内骨化,而且也发生在病理情况,在老年人的主动脉和肋软骨以及骨恶性肿瘤均同样有基质小泡增加,导致钙化。
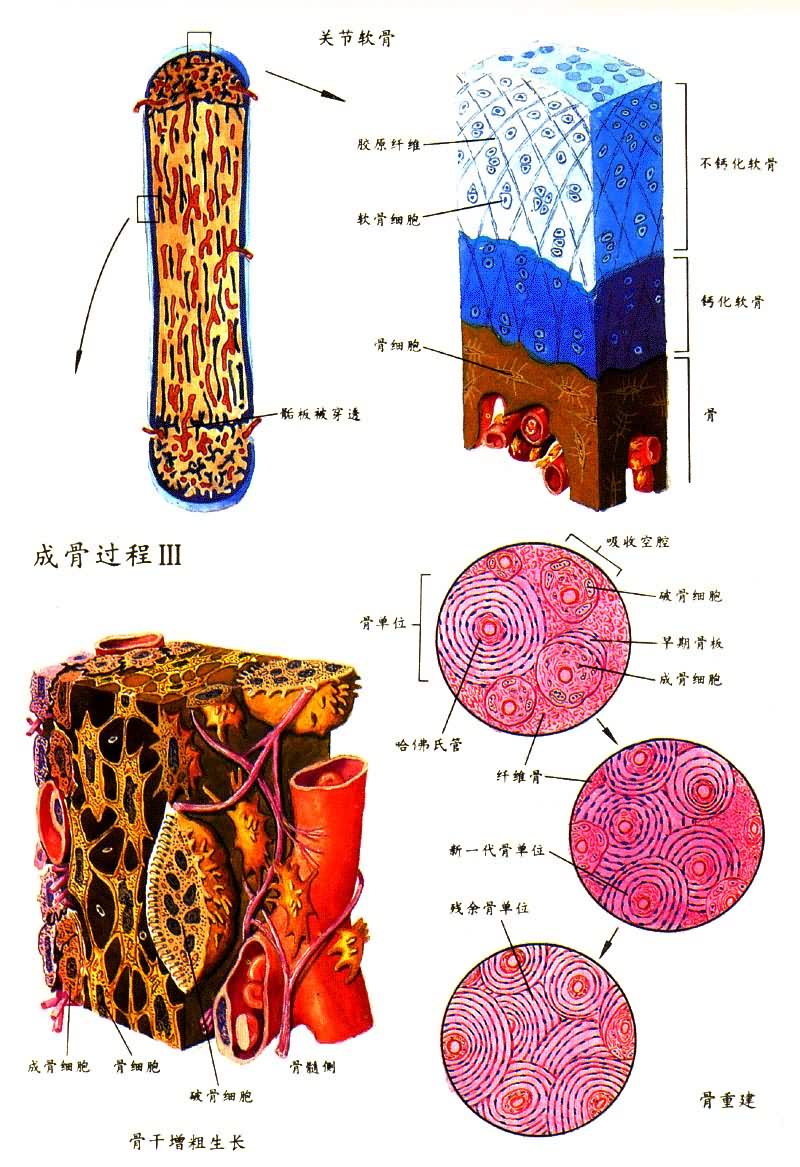
骨的微细结构 密质骨主要由矿化的间质(骨基质)构成,形成板层状──骨板。骨间质内均匀地分布着腔隙──骨隐窝,每个陷窝有一个骨细胞。骨陷窝间有辐射状小管道──骨小管相连,营养物质可以从小管系统达到骨细胞,骨板大多数围绕骨内的纵行血管通道呈同心圆排列,4~20层骨板形成圆柱形的结构单位──哈弗斯氏系统(或称骨单位)。横断面上,哈弗斯氏系统呈同心环状,围绕中心的圆孔。纵断面上则呈若干与血管腔平行排列的紧密板层;哈弗斯氏系统之间有大小不等、形状不规则的多角形骨板断片──间板。在骨皮质外表面、骨外膜下及靠近骨内膜内表面处,有几层连续的骨板围绕中心排列的骨板──外环骨板及内环骨板。哈弗斯氏系统中心的纵行管道称为哈弗斯氏管,有1~2个血管走行。骨板上有横行或斜行小管──福尔克曼氏管贯穿福尔克曼氏管将哈弗斯氏管连接,血管经此相通。
骨的生物力学 骨在结构上为非均质及各向异性。干骨呈脆性,相对伸长0.4%将被破坏;湿骨的相对延伸率较高,为1.2%。骨具有相对较高的拉伸强度,其拉伸弹性模量大于压缩弹性模量。
长骨受到的力是通过关节传递的力,和肌肉收缩力,骨干承受以弯曲、压缩变形为主的组合变形。
骨在形态构造和力学性能上充分适应其功能,其改变受作用其上的应力-应变控制。骨的生长发育受压力-应变调整。在骨组织与机械力之间存在一种生理平衡。应力增加会引起骨质增生,而应力降低又会引起骨质吸收。这种变化既包括外塑型即增生吸收的变化,又包括内塑型即钙磷含量的变化。正常非连续载荷的刺激对骨的生长有利,而超过或低于正常的载荷则会影响骨组织生长。
骨骼的结构在纵横方向上有所不同,其强度也随载荷方向而异,在最常承受载荷方向上,骨骼强度和刚度最大,密质骨又大于松质骨。附着在骨骼上的肌肉可改变其应力分布。肌收缩时所产生的压应力可降低或消除加于骨骼上的拉应力。松质骨为多孔结构,具有较高储存能量能力,应变超过原始骨长度7%时才发生断裂,而在密质骨只超过 2%时就可以断裂。加载速度可影响骨折的类型和邻近软组织的损伤程度。当载荷频数超过防止断裂所需重建速度时,骨骼可发生疲劳性损伤。
骨骼可自行修复,随力学要求而改变其性质和外形,经一段废用(如因病长期卧床)或活动明显增加后,可观察到骨骼密度的改变,骨骼具有适应力学对其要求的能力,重建时在需要处形成,而在不需要处被吸收。骨可以通过自身形成与吸收保持内部压力水平,适应外力变化。
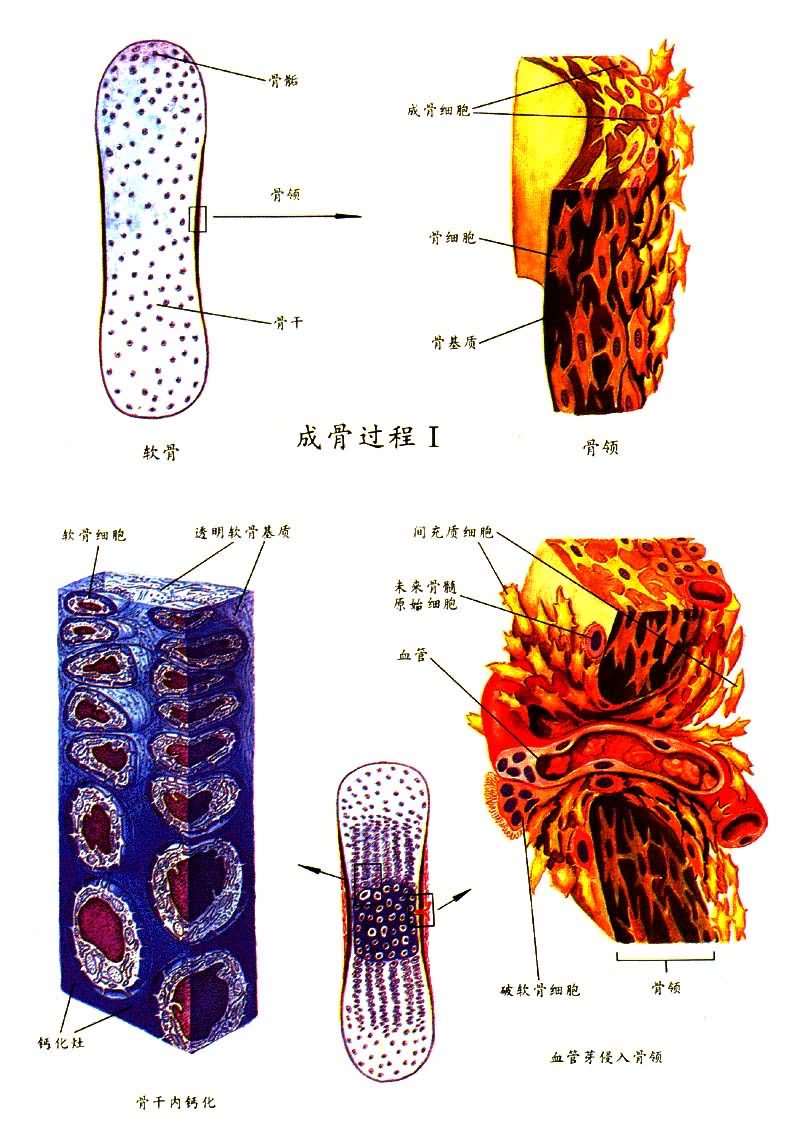
骨的发生 骨来源于胚胎时期的间充质,其发生有两种方式,即膜内骨化和软骨内骨化。
膜内骨化 直接从胚胎结缔组织膜内形成骨组织,如颅盖骨及面骨间充质细胞分化为许多成骨细胞,形成成骨中心。在其周围分泌有机基质,细胞被埋于其中,于是形成类骨质,此后骨盐沉积其上就成为骨组织。最初形成的骨质由骨针相连成网,没有骨板,骨盐也少,腔隙多。成骨中心向四周扩展。原始的骨松质随后也被吸收,改造为具有骨密质的内、外骨板,其间的骨松质即板障。颅面骨的形状和曲度与脑的发育相适应,表面生长较多,内面破坏较多,使颅腔相应扩大。
软骨内骨化 由胚胎间充质分化成未来骨的软骨雏形,在未来的骨干部位,软骨膜开始以膜内成骨方式环绕软骨中段生成骨领,其他部分则继续增厚加长,成为原始骨松质,代替软骨起支持作用,骨领周围的软骨膜即变为骨外膜。人体四肢的长、短管状骨以及躯干的不整形骨都是软骨内化骨。
与骨领出现的同时,软骨中段的软骨细胞分裂增殖肥大,随后软骨基质内有钙盐沉着,肥大的软骨细胞即退化死亡。骨外膜血管连同间充质细胞、成骨细胞及破骨细胞穿过骨领进入软骨,形成初级骨化中心,而被溶解的钙化软骨基质则形成初级骨髓腔。成骨细胞贴于钙化软骨基质的表面,先形成类骨质,而后钙化为骨质,构成原始骨小梁。由初级骨化中心形成的骨小梁不断被破骨细胞溶解而消失,初级骨髓腔亦不断融合扩大。骨领外面的成骨使骨干不断加粗,而其内面又不断被破骨细胞破坏,因此骨髓腔不断加宽。骨干经不断改建,形成骨密质,呈现环行骨板,出生后一年左右开始形成由多数同心圆排列的哈弗斯氏系统。与此同时,初级骨化中心的成骨过程逐渐向两端推移。出生前后,在长骨两端软骨内,出现次级骨化中心,其成骨过程基本与初级骨化中心相似,以后又经过不断吸收改建形成骨松骨,但在关节面始终保持一层关节软骨。在骨骺与骨干交接处,在发育成熟以前保持一层软骨,即骺板。此处软骨细胞排列成柱,由静止区依次向增殖区、肥大区、钙化区转变。随后由骨髓腔来的血管连同间充质细胞、成骨细胞及破骨细胞侵入,一方面破骨细胞破坏钙化的软骨基质,而成骨细胞则沿着残留的钙化基质表面生成骨组织,形成骨小梁。骨干由于骺板成骨,其长度得以不断增加。正常情况下,骺板软骨的增殖、破坏与成骨增长速度保持平衡,故骺板厚度相对稳定。17~20岁左右,骺板闭合,骨干即停止生长,因维生素D缺乏而发生佝偻病时,软骨柱变长,不能很好骨化,因此骺板加宽,呈杯口状。
骨是有生命的活的器官,具有生长发育和新陈代谢特点,并有破坏改建及创伤愈合修复再生的能力。经常锻炼,骨发育良好;长期不用,则萎缩退化。
骨的再建 人的一生中骨骼内不断进行的更新与改造,先由破骨细胞移除一定量的骨组织,再在吸收区形成新的骨组织。骨骼有4种自然包被或表面,后三者也称为内包被,复盖骨的全部软组织。骨具有广阔的表面,这不仅有利于骨内血循环与全身组织进行交换,也有利于骨组织的转换,即骨组织更新替代。
骨再建过程中,骨再建单位按一定的顺序和方式进行,在骨一定间隔,先由前体细胞分化,激活,形成一组破骨细胞进行骨吸收,随后消失,然后出现另一组成骨细胞,进行骨形成,填补刚刚被吸收的陷窝。骨形成只在刚完成的骨吸收部位进行。这个再建过程可简写为ARF ,即激活,吸收、形成。整个周期可用σ表示,约为4~5个月,儿童最快,20岁左右逐渐下降,35岁达最低点,以后又缓慢上升,成年后发生的骨代谢病多表现为骨再建紊乱。
骨再建受很多因素影响,甲状旁腺激素作用于肾小管,可使尿磷增加而血磷降低,间接影响骨的生长,还可直接作用于骨,促进骨吸收,使血钙升高,甲状旁腺激素促进 RNA合成,增加细胞去极化,结果细胞膜对钙的通透性增加,骨吸收增加。甲状旁腺激素的骨吸收作用需要维生素D存在,低钙血能刺激甲状旁腺激素而使骨钙动员,促进骨吸收,高钙血能刺激甲状腺C细胞分泌降钙素(CT),阻止钙动员,抑制骨吸收,维生素D代谢产物均能刺激骨吸收,在体外,1,25-(OH)2D3比25-(OH)D3高100倍,但在体内,由于25-(OH)D3浓度比1,25-(OH)2D3高得多,因此在骨吸收管制上更重要。破骨细胞有接受PTH与CT的受体,人的淋巴细胞可产生破骨细胞激活因子,可诱导破骨细胞,促进骨吸收。
骨愈合 骨骼损伤(如骨折)后,只要断端固定及血供良好,均可通过骨痂自行愈合。若缺损较大,则需植骨,其中以植自体松质骨最好。
早在60年代,乌里斯特即提出骨形态形成蛋白(BMP)概念,其重要性在于能在体内或体外培养中诱导间充质细胞分化为软骨或骨组织,对修复骨缺损是一个很大的进展,目前已从牛、猪等骨中提取部分纯化的骨形成蛋白,在植入物吸收的同时,体内不断释放 BMP和骨骼生长因子(SGF)。BMP在吸收部位诱导血管周围间充质细胞分化为成骨细胞,而 SGF作为有丝分裂原,能刺激成骨细胞增长,使其成倍增长,这样新骨就在吸收部位不断形成。
动物实验显示,用同种骨基质明胶 (BMG)脱钙骨基质(DBM)植入骨缺损处,也能诱导新骨形成,这与该植入物释放BMP有关。用脱钙异体骨移植,随脱钙时间长短不同,对骨愈合的影响也不同,脱钙时间长者,植入的异体骨无抗原性,新骨形成多,愈合快,力学强度好;相反,脱钙时间短者,有弱抗原性,新骨形成少,愈合慢,力学强度差。这可能由于异体骨中矿物质含量较多,阻碍BMP的骨诱异作用所致。异种骨移植可在受体引起强烈的免疫排斥,这是由于异种骨基质中许多有机成分都是抗原性物质,通过体外处理减弱植骨抗原性的同时保留其成骨能力,这是异种骨移植成功必须解决的问题。