热力学第三定律(卷名:物理学)
third law of thermodynamics
研究当温度趋于绝对零度时物质性质的热力学定律。用热力学第二定律的公式
 确定熵时,留下一个常数无法确定。但已知许多物理、化学现象和此常数有重要关系。热力学第三定律解决了确定熵常数的问题。
确定熵时,留下一个常数无法确定。但已知许多物理、化学现象和此常数有重要关系。热力学第三定律解决了确定熵常数的问题。在等压条件下的化学反应热Q和化学亲合势A有下列关系:
 即
即 式中Q是系统经等压过程吸收的热量,它等于系统的焓变Q=-ΔH;A是化学亲合势,它等于吉布斯函数的减小量A=-ΔG。大量实验结果表明:当温度趋于绝对零度时,化学亲合势和反应热相等,并且当T→0时,Q-A这个量趋于零的速度比T的一次方趋于零的速度快,即有关系
式中Q是系统经等压过程吸收的热量,它等于系统的焓变Q=-ΔH;A是化学亲合势,它等于吉布斯函数的减小量A=-ΔG。大量实验结果表明:当温度趋于绝对零度时,化学亲合势和反应热相等,并且当T→0时,Q-A这个量趋于零的速度比T的一次方趋于零的速度快,即有关系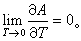 从热力学关系
从热力学关系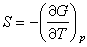 很自然得到
很自然得到 此式就是W.能斯脱在研究低温下各种化学反应性质时,总结大量实验资料于1906年提出的一个普遍规律,称为能斯脱定理。表述为:凝聚系的熵在等温过程中的改变随热力学温度趋于零。这个定理后来称为热力学第三定律。由能斯脱定理可推出另一原理:“不可能用有限手续使一物体冷却到绝对温度的零度”,这个原理叫做绝对零度不能达到原理。它是热力学第三定律的另一种表述。
此式就是W.能斯脱在研究低温下各种化学反应性质时,总结大量实验资料于1906年提出的一个普遍规律,称为能斯脱定理。表述为:凝聚系的熵在等温过程中的改变随热力学温度趋于零。这个定理后来称为热力学第三定律。由能斯脱定理可推出另一原理:“不可能用有限手续使一物体冷却到绝对温度的零度”,这个原理叫做绝对零度不能达到原理。它是热力学第三定律的另一种表述。后来人们发现,能斯脱定理只适用于晶体,对非晶体不适用,而绝对零度不能达到原理则更具有普遍性,所以把绝对零度不能达到原理作为热力学第三定律的标准说法,而把能斯脱定理作为它的推论。
1911年M.普朗克提出绝对熵的概念,即规定绝对零度时熵本身等于零,而不是熵的改变等于零,即
 在这样规定之后,熵的数值中就不再包含任意常数了。绝对熵的说法可以代替能斯脱定理,且更为简单。
在这样规定之后,熵的数值中就不再包含任意常数了。绝对熵的说法可以代替能斯脱定理,且更为简单。在第三定律建立之前,计算熵的普遍公式为
 其中So为标准温度To时熵的数值,So是参量x(x可代表体积、压强等)的函数,Cx为热容,根据第三定律,取T=0为标准温度,则因So=0而有
其中So为标准温度To时熵的数值,So是参量x(x可代表体积、压强等)的函数,Cx为热容,根据第三定律,取T=0为标准温度,则因So=0而有 其积分下限必须是零,积分时保持参量x不变。这样,熵的数值就完全被确定了。
其积分下限必须是零,积分时保持参量x不变。这样,熵的数值就完全被确定了。热力学第三定律本身不能用实验直接验证,其正确性是由它所得到的一切推论都与实验观测相合而得到了保证。下面用几个典型例子说明理论推论与实验观测值的符合情况:
①从第三定律出发并利用麦克斯韦关系推出温度趋于绝对零度时,物体的定压膨胀系数趋于零。图1是金的线胀系数α 随温度变化的曲线。可以看出,当T→0时,
 与理论结果一致。
与理论结果一致。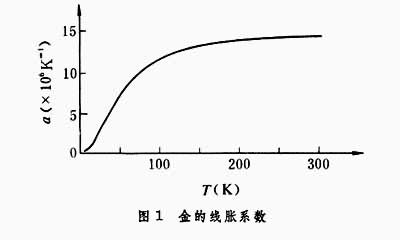
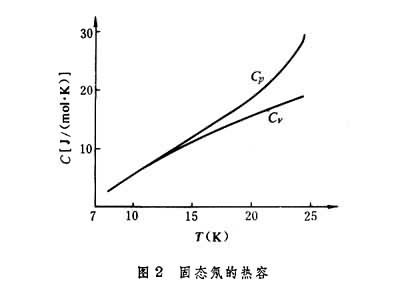

②理论推出
 ,图2为固态氖的(摩尔)热容随温度变化的实验曲线,它显示出低温时定压热容和定容热容趋于一致。
,图2为固态氖的(摩尔)热容随温度变化的实验曲线,它显示出低温时定压热容和定容热容趋于一致。③理论推出,固、液二相转变时的平衡压强随温度的变化,在T→0时,趋于零。图3表示出4He在低温下的熔解压力随温度变化的关系,由图可见,随T→0,斜率dP/dT趋于零。
第三定律在热力学中是根据实验事实总结出来的,但利用量子态的不连续概念,可以从量子统计理论导出它的结论。
参考书目
王竹溪著:《热力学》,高等教育出版社,北京,1955。
D. C. Kelly,Thermodynamics and Statistical Physics,Academic Press,New York and London, 1973.