相图(卷名:物理学)
phase diagram
又称为平衡图或状态图。相图是处于平衡状态下物质的组分、物相和外界条件相互关系的几何描述。原则上相图可以用成分和任何外界条件为变量来绘制,然而温度T、压强p以外的外界条件,如电场、磁场等,在一般情况下,对于复相平衡不发生影响或影响很小,所以相图通常是以组分、温度和压强为变量来绘制的。
相是体系中具有同样的物理性质和化学性质,与数量无关的任何均匀部分,相与相之间有分界面。在多相平衡体系中各个相关相之间彼此互相转化的速率相等,即化学势相等。和其他平衡一样,相平衡也是相对的,有条件的。在相平衡态时,同一相内成分必须是均匀的、恒定的。温度必须是恒定的。如果有气体存在,压力也必须是均匀的、恒定的。其他影响相平衡的外界条件,如电场、磁场等都必须是不变的。体系处于平衡态时可能是单相、两相或多相的。相的数目由相律(自由度=组元数—相数+外界条件数)确定。相除了气体、液体和固体外,对于晶态固体还可能有不同的多形性。
单组元的相图通常用压强 p和温度 T为变量来标绘。如图1所示,单相平衡状态在一个平面上,两相平衡在一条曲线上,三相平衡是一个点。图1中的SLG表示物质的固液气三相, a点相当于固、液、气三相的共存点,称三相点,三相平衡点是无自由度的点,因为任何一个变量的变化都会引起平衡的破坏。如果在固态存在着多形的话,则在p-T图上还可能有其他三相点。
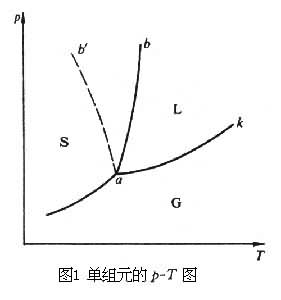
液—气平衡曲线ak终止在临界点k上,熔化曲线ab没有临界点。对于大部分物质,凝固时体积减小,液—固曲线的斜率为正,如图1的ab。对于熔化时体积减小的物质(如水等),压强增加,熔点下降,则液—固平衡曲线的斜率为负,如图1的ab′。
对于两组元的相图,当p、T都是变量时,相图是三维的,其坐标轴为p、T、x(x为某一组元的重量或克分子百分比)。这类相图研究得最多的是p=1大气压的截面,这个截面通常称为二元系相图。
图2a~2m是恒压下二元系相图的基本类型,其二相平衡区可能是固—气(升华图),液—气(沸腾图),固—液(熔化图),还可能是固—固(多形性相变)。为了便于说明问题,把图2a~2m作为熔化图来描述。










互溶体系 如图2a~2c所示,在这一类体系中,二组元间不形成任何化合物,无论在液态或固态,二组元都能以任何比例互相溶解。Ta为A组元的熔点,Tb为B组元的熔点,TaeaTb为液相线,TabdTb为固相线。在液相线以上为液相稳定区,在固相线以下为固相稳定区,在液相线与固相线之间为固—液二相共存区。设有一成分为с 的液体,当温度下降到t1时,开始析出固相,其成分为d,温度由t1降到t2液相成分沿ae曲线变化,固相成分沿db曲线改变,在温度t2时,液体全部凝固。
作为这一类型相图的两种特殊情况是:如图2b所示的液相线与固相线相切于最低点的最低熔点互溶体系,和图2c所示的液相线与固相线相切于最高点的最高熔点互溶体系。值得注意的是,相应于切点成分的合金熔化与凝固是在同一温度,且固体与液体成分相同的情况下进行的。
根据相图,可以应用杠杆定律测定处于平衡二相的相对含量,如图2a温度为t时,成分为xL的液体与成分为xS的固体处于平衡状态,当总成分为с时,固相含量мS与液相含量мL之比为oe/op。
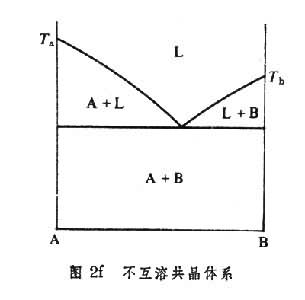
共晶体系 如图2d所示,二组元间不形成化合物,液态完全互溶,固态部分互溶。在TaETb以上是液相区,TaE是液相线,在这线上,液相与组元B溶在组元A中的固溶体α相平衡,同样,TaE是液相与组元A溶在组元B中的固溶体β相平衡的液相线。Taс和Tbd是相应的固相线。сe与df分别为不同温度下B在A中和A在B中的固溶度曲线。eсdf以下是α和β二相共存区。сEd为共晶线,E为三相点,称共晶点,相应的成分称共晶成分,如图2d的xe。成分为xe的合金在共晶温度tc结晶,形成α与β的机械混合物,即
 。非共晶成分的液体结晶时,首先析出的是α相或β相,共晶成分的剩余液体在tc结晶。
。非共晶成分的液体结晶时,首先析出的是α相或β相,共晶成分的剩余液体在tc结晶。在固态也存在类似的相图,称共析体系,其反应为:
 。相应的相图见图2e。
。相应的相图见图2e。这类相图的极端情况,如图2f,在固态完全互不相溶。
包晶体系 如图2g,在液态完全互溶,在固相为包晶型的有限固溶体。在包晶反应温度tp,
 三相处于平衡状态,p为三相点,当成分处于ap范围的合金冷却时,首先析出的是 α固溶体,当温度降至tp时,成分为 b的剩余液体与 α固溶体相互作用形成β固溶体。在通常条件下,合金全部结晶后,物质是由β固溶体包着α固溶体所组成,因而称为包晶反应。
三相处于平衡状态,p为三相点,当成分处于ap范围的合金冷却时,首先析出的是 α固溶体,当温度降至tp时,成分为 b的剩余液体与 α固溶体相互作用形成β固溶体。在通常条件下,合金全部结晶后,物质是由β固溶体包着α固溶体所组成,因而称为包晶反应。在固态中也存在着类似的反应,这种反应称为包析反应:
 。
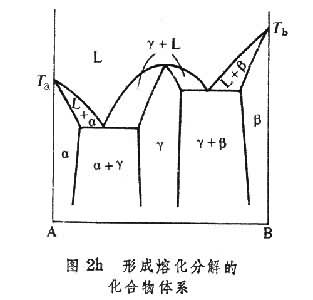
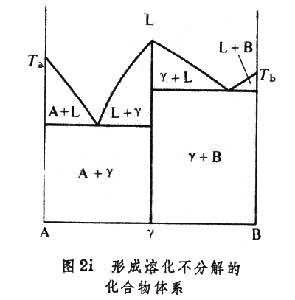
。形成同成分熔化化合物的体系 如果所形成的化合物在液态分解为两组元,则化合物γ的液相线具有平滑的最大值,液相线的切线在最大值是水平的,如图2h。如果两组元所形成的化合物γ相,在熔化为液态后不分解,如图2i,则相应于γ相的两条液相线相交于最大值,并在最大值处有一定的交角。对于这样的化合物可以看成是一个独立的组元,分别与组元A和B形成两个独立的相图。
具有由包晶反应形成化合物的体系 如图2j,化合物γ加热至包晶反应温度分解为成分为a的α固溶体和成分为с的液体,称非同成分熔化。一般说来,在这样的体系中化合物附近部分的液相线有潜在的极大值,而且这类化合物不能看作是独立的组元。
液态分层体系 在液态不完全互溶,固态具有有限的固溶度或形成化合物,其中一个三相平衡线是两种分层液体与一固体的平衡。如图2k所示的偏晶体系,它是一种分层液体L1与固溶体α和另一种液体L2呈平衡,即
 ,称偏晶反应。另一种情况是图2l所示的综晶体系,它是两种液体L1和L2与γ相呈平衡,即
,称偏晶反应。另一种情况是图2l所示的综晶体系,它是两种液体L1和L2与γ相呈平衡,即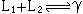 ,称综晶反应。
,称综晶反应。还可能存在着两组元无论在固态、还是在液态,实际上都不相溶,如图2m。当然,严格讲,即使溶解度非常小,两组元总会有一定的互溶度的。
对于气相,由于气态各组元能完全混和,不存在这类分层型的相图。
实际上,除了图2a~2m所列举的相图类型外,特别是在金属体系,还能遇到更加复杂的相图形式。然而不管多么复杂,总可以把它们分解成以上这些基本类型来处理。
当压强变化时,不仅相图的相界位置可能发生变化,相图的类型也可能发生变化。例如图2a类型的相图,当压强增加时,可以逐渐转变为图2b与图2d类型的相图,或转变为图2c与图2g类型的相图。在压力作用下,相图类型发生变化的可能性表明,不同相图之间不存在明显的分界线,它们是相互联系的。同时在压力的作用下还可能出现新的化合物。
三元系相图 当压强p不变时,三元系相图是三维的,它是正三角棱柱体,其基底是浓度三角,高是温度轴。浓度三角的顶表示组元 A、B、C。相应的边是二元系。三角形内部不同的点表示由三个组元形成的三元合金,组元浓度的确定有二种方法,见图3a或3b。


三元系相图在平面上通常用二种方法表示:等温横截面图与垂直于浓度三角的纵截面图。
在等温截面图上,相界是用代表某一温度的平面与固相面和液相面等相交得出的曲线。平衡共存的两个相的代表点连线称为结线,结线的走向用实验方法确定。结线的端点决定共存相属于哪两相和它们的成分。处在平衡的两相的相对含量可用杠杆定律确定,三个相的相对含量用结线三角形"重心"定律(如图3b)来确定。
纵截面图可以看成是二元系,但它不同于二元系相图。一般说来,它不具有相平衡的性质。但如果纵截面图通过化合物与浓度三角形的一个顶点,或是通过二个化合物,这样的纵截面称为赝二元系,可以按二元系处理。
对于多元系的相图,要用特殊的方法来描述,最普通的是基于多元素的拓扑分析理论。
相图是相平衡的几何表示,相平衡是从热力学的平衡条件,即在等温、等压下热力学势 G最小推导出来的,所以在每一个相的 G与T、p、x的关系都知道的情况下,相图也可以从理论上计算出来。但由于热力学参数的测量有时存在着困难,实际上也可以从相图计算出平衡状态下的热力学参数。
实际上目前主要的还是依靠各种实验方法来测定相图。从原则上讲,一切随成分、温度和压强而变化的物理性质都可以作为测定相图的依据。但最可靠和常用的X射线结构分析、热学分析以及显微分析,因为它们可以揭露相的结构和热力学的稳定性。由于各种实验手段都有其特定的灵敏度,必须互补,才能避免确定相界时可能发生的错误。
相图在材料科学中得到广泛的应用,它可以提供有关体系的物理化学过程,什么组分在什么条件下应该出现什么相。可以根据相图,提高和改善材料的性能,正确确定材料的合成和热处理工艺。对于单晶体生长,相图可以帮助选择晶体生长的方法,确定配料成分,以及提高晶体完整性的工艺等。在探索新材料时,相图的研究可以发现新的化合物,提供物质的组分、结构和性能相互关系的丰富资料。
参考书目
F. N. Rhines, Phase Diagrams in мetallurgy-Their Development and Application, McGraw-Hill, London, New York, 1956.
M. Hansen, Constitution of Binary Alloys, 2nd ed., 2nd Supplement, McGraw-Hill, New York, 1969.
E.M.Levin,et al.,Phase DiagRam for CeRamists, Amer. Ceram, Soc.,1956; Supplement, 1969,1975.