铍(卷名:矿冶)
beryllium
元素符号Be,钢灰色金属,在元素周期表中属ⅡA族,原子序数4,原子量9.01218,密排六方晶体,常见化合价为+2。
1798年法国人沃克兰 (L.N.Vauquelin)发现铍的氧化物。1828年,德国化学家沃勒(F.Whler)和法国化学家比西 (A.A.B.Bussy)各自用钾还原氯化铍的方法,分别制得单质的铍。沃勒将它命名为beryllium(Be),而比西则命名为glucinium(Gl),1957年才由国际纯粹化学与应用化学联合会 (IUPAC)按前者定名。1898年法国人勒博(P.Lebeau)用电解氟化钠-氟铍酸钠熔体的方法制得小颗粒的铍。
已知含铍矿物有30多种,但直到1968年,其中仅绿柱石具有工业价值。绿柱石是一种铍铝硅酸盐,其通式为3BeO·Al2O3·6SiO2,理论上含BeO近14%。实际上BeO含量一般为9~13%;主要产于巴西、阿根廷、印度、南非等。中国新疆、江西等地也出产。1968年开始使用含水硅铍石[Be4Si2O7(OH)2]制铍。含水硅铍石中氧化铍的理论含量为39~42%,但是工业矿物呈高度分散状态,氧化铍含量只有1.7~2.5%;主要产于美国。
性质和用途 铍在室温下的抗氧化能力近似铝,在干燥空气中于600℃可长时间抗氧化;于800℃可短时间抗氧化。铍在低温高纯水中具有优良的抗蚀性。室温下,铍易与稀硫酸反应,与浓硫酸反应缓慢;与稀硝酸和醋酸发生反应,与浓硝酸和冰醋酸不发生反应;但在高温下则与浓硝酸发生反应。铍与浓的碱溶液激烈反应;在略高于铍熔点的温度下,与碳反应生成碳化铍;略高于900℃时可与氮作用;1000℃下粉末状金属可与氨作用生成氮化铍。
X 射线对铍有很高的透过能力。铍核被中子、α 粒子、氘核及γ射线撞击或照射时产生中子,因此铍是一种中子源材料。铍原子的热中子吸收截面为 0.009靶恩。
工业用铍大部分以氧化铍形态用于铍铜合金的生产(见铜合金),小部分以金属铍形态应用,另有小量用做氧化铍陶瓷等。40年代前金属铍用做 X光窗和中子源等,从40年代中期到60年代初,主要用于原子能领域,如利用铍能使中子增殖作试验反应堆的反射层、减速剂和核武器部件等。1956年惯性导航系统首次使用铍陀螺,从此开辟了铍应用的重要领域。60年代铍的主要用途转入航天与航空领域,用于制造飞行器的部件(见铍材)。
1980年世界铍矿石的生产能力(以铍计)约为1315吨。实际产量受军备、原子能和空间计划的影响,波动较大。1972~1974年,世界铍矿的年产量(以铍计)约为185吨。1976年以后,美国铍的消费量逐年增长,1980年达到 300吨。1977~1980年铜铍中间合金中铍的价格为135美元/公斤,纯铍265~307美元/公斤,陶瓷级氧化铍为57美元/公斤。绿柱石精矿(BeO10~12%)为75~85美元/短吨。
工业上金属铍的生产一般分为两步:第一步是从绿柱石中提取氧化铍,第二步是由氧化铍制取金属铍。
氧化铍的提取 有硫酸盐法和氟化物法。
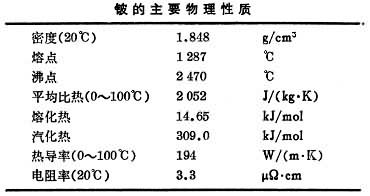
硫酸盐法 先将绿柱石在1600~1700℃熔融,熔体用冷水水淬,得到的细粒状玻璃体,磨细到-200目,与浓硫酸混合,在250~300℃反应,使铍、铝氧化物转化成水溶性硫酸盐,而二氧化硅则不与硫酸发生反应,入渣弃去。在浸出液中加氨中和游离的硫酸,产生的硫酸铵同硫酸铝化合形成铝铵矾[NH4Al(SO4)2·12H2O]沉淀,从而使铝大部除去。然后利用铍、铝离子在碱性溶液中稳定性的不同,使铍、铝进一步分离。例如在溶液中加入乙二胺四乙酸(EDTA)螯合剂和氢氧化钠可使铝、铁、铬、锰、稀土等杂质保持在溶液中。然后把溶液加热到接近沸点,铍酸钠便水解生成氢氧化铍沉淀而与杂质分离。于750~800℃煅烧氢氧化铍,即成工业氧化铍(图1)。
氟化物法 将磨细的绿柱石和氟硅酸钠或氟铁酸钠混合制块,在750℃烧结,矿石中的铍转化为水溶性的氟铍酸钠,而铝、铁、硅等仍保留氧化物状态。烧结块磨细后,用水浸出(见浸取)、过滤,滤液中加入氢氧化钠,得到铍酸钠溶液。煮沸溶液,铍酸钠便水解沉淀,得到工业纯氢氧化铍,再煅烧成氧化铍。残液用硫酸高铁处理,生成氟铁酸钠沉淀,回用制块。此法铍的回收率在90%以上,比硫酸盐法高。
从含水硅铍石提取 60年代末开始以含水硅铍石为提取铍的原料。这种原料中的铍呈简单的硅酸盐形态,用硫酸在近沸温度直接浸出。所得铍溶液,用溶剂萃取处理,以D2EHPA[二(2-乙基己基)磷酸]煤油萃取,铍进入有机相,然后用碳酸铵溶液反萃,反萃液通过分步水解,除去铁和铝,最后加热到95℃,得Be(OH)2·2BeCO3沉淀。
金属铍的生产 氧化铍极难直接还原成金属,生产中先将氧化铍转化为卤化物,然后再还原成金属。有两种工艺:氟化铍镁还原法(见金属热还原)和氯化铍熔盐电解法。
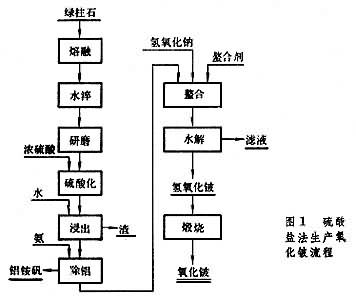
氟化铍镁还原法 将氢氧化铍溶于氟氢化铵(NH4F·HF)溶液中,得氟铍酸铵 [(NH4)2BeF4]溶液。然后加碳酸钙除铝;加过氧化铅(PbO2)除锰、铬;加多硫化铵[(NH4)2Sx]除重金属杂质,经真空蒸发、浓缩结晶得纯净的氟铍酸铵。结晶在900℃进行热分解,得熔融氟化铍,铸成小锭,用于还原。镁还原按BeF2+Mg─→Be+MgF2进行反应。还原过程开始于 900℃,结束时升至1300℃,以利金属与渣分离。生产中镁的用量通常只有化学计算值的70%。过量的氟化铍可以降低渣的熔点和粘度,有助于金属铍的聚结和渣的分离,还能防止因反应放热而使温度急升,引起镁的大量挥发。在还原产物进行水浸处理时,过量的氟化铍迅速溶解,使金属铍珠更易分离。还原所得金属铍珠经真空熔炼,除去未反应的镁、氟化铍和氟化镁等杂质后,铸成铍锭(图2)。
氯化铍熔盐电解法 先将氧化铍和碳还原剂混合,加焦油等粘结剂制成球团,在900℃以上焦化,所得焦化块装入氯化炉,在700~900℃通入氯气进行氯化,得到氯化铍。氯化铍在镍制坩埚内进行熔盐电解。坩埚内放置镍制圆筒作阴极,中心悬置石墨棒作阳极。纯无水氯化铍与等量的纯氯化钠混合、熔融,在350℃下进行电解。电解周期结束后取出沉积物,用冰水浸洗,除去熔盐,得到鳞片状的金属铍。经真空熔炼,浇铸成锭(见氯化冶金)。
为制备较高纯度的铍,可将粗铍用真空蒸馏、熔盐电解精炼或区域熔炼等方法进行精炼。
铍毒 40年代初期开始逐步确认铍及其化合物对人的危害。铍及其化合物的粉尘、烟雾能引起人体很多器官的急性或慢性中毒。急性中毒是在短时间接触或吸入大量毒物引起的,病症包括接触性皮炎,皮肤溃疡,眼结膜炎,呼吸系统的鼻粘膜炎、咽炎、支气管炎、化学性肺炎等。慢性中毒是迟发性的,发病时间可迟至接触毒物后20年。主要表现为肺部的长期延续性病变。
铍的毒害主要产生于粉尘、烟雾的吸入和接触,各国曾制定了防范性的卫生标准。1949年美国确定的空气含铍允许浓度的标准:①车间工作时间内空气中铍的浓度平均不得超过2微克/米3;②任何时间一次检测车间空气中的铍浓度不得超过25微克/米3;③铍厂邻近地区空气中铍的月平均浓度不应超过0.01微克/米3。
参考书目
D.R.Floyd, G.J.London, D.Webster, J.N.Lowe ed.,Beryllium Science and Technology, Vol.I & Ⅱ,Plenum,New York, 1980.
H.H.Hausner ed., Beryllium,Its Metallurgy and Properties, University of California Press,Berkeley,1965.